Bài viết Những cập nhật mới nhất về sinh bệnh học nám da – tải file PDF Tại đây.
Tác giả: Ana Claudia C. Esposito; Daniel P. Cassiano; Carolina N. da Silva; Paula B. Lima; Joana A. F. Dias; Karime Hassun; Edile ́ia Bagatin; Luciane D. B. Miot; Helio Amante Miot
Dịch: Bs. Trương Tấn Minh Vũ
TÓM TẮT
Nám da là một rối loạn sắc tố đa yếu tố, là kết quả của việc tiếp xúc với các yếu tố bên ngoài (như bức xạ ánh sáng mặt trời) và các yếu tố nội tiết (như hormone sinh dục và thai kỳ), cũng như tình trạng viêm của da (như viêm da tiếp xúc và thủ thuật thẩm mỹ), ở những người dễ bị mắc có tính di truyền. Ngoài các tế bào hắc tố (melanocyte) tăng chức năng, da bị nám biểu hiện một loạt các thay đổi về cấu trúc và chức năng ở lớp biểu bì (epidermis), màng đáy (basement membrane, BM) và lớp lớp bì nông (upper dermis), tương tác để tạo ra và duy trì một kiểu hình tăng hắc tố khu trú. Sự phát triển về kiến thức của cơ sở di truyền trong nám và đáp ứng của da đối với bức xạ mặt trời, cũng như vai trò của các yếu tố nội tiết, hệ thống chống oxy hóa, tăng sinh nội mô, lão hóa nguyên bào sợi, thoái hóa tế bào mast, sự suy giảm khả năng tự thực bào của melanocyte và điều hòa cận tiết của sự hình thành hắc tố melanin (melanogenesis), sẽ dẫn đến sự phát triển của các phương pháp điều trị mới và các chiến lược phòng ngừa mới. Tổng quan này trình bày kiến thức hiện có về các khía cạnh của cơ chế bệnh sinh của nám và thảo luận về tác động của các phương pháp điều trị cụ thể và nghiên cứu trong tương lai về những vấn đề này
GIỚI THIỆU
Nám da là một chứng tăng hắc tố khu trú mãn tính thường gặp ở các vị trí tiếp xúc với ánh sáng ở người lớn, đặc biệt là phụ nữ trong độ tuổi sinh sản. Trong khi sắc tố da do rám nắng và tăng sắc tố sau viêm tự mờ đi sau khi ngừng kích thích, sự giảm đi này thường không xảy ra trong nám. Nám phát triển từ sự thay đổi ở một số lớp của da và loại tế bào tới các melanocyte tăng chức năng, sản sinh và vận chuyển các melanosome trưởng thành đến toàn bộ lớp biểu bì [1].
Tổng quan này nhằm mục đích đối chiếu những phát hiện hiện tại về cơ chế bệnh sinh của nám. Trong các phần tiếp theo, chúng tôi củng cố khái niệm nám da là một rối loạn đa yếu tố và thảo luận về nhiều khía cạnh tương tác trong cơ chế bệnh sinh của nó, liên quan đến di truyền, bức xạ mặt trời, kích thích nội tiết, tình trạng oxy hóa, cũng như những thay đổi về hình thái. Cuối cùng, mặc dù sự hiểu biết về nám chưa đầy đủ, chúng tôi trình bày một mô hình gây bệnh dẫn đến sự kết hợp của tất cả các yếu tố này. Bài viết này dựa trên các nghiên cứu đã được tiến hành trước đó và không chứa nghiên cứu mới nào có sự tham gia của người hoặc động vật do bất kỳ tác giả nào thực hiện.
DI TRUYỀN
Nám da là một rối loạn đa yếu tố được đặc trưng bởi một kiểu hình da do tiếp xúc với các yếu tố bên ngoài (như tiếp xúc với ánh nắng mặt trời) và các yếu tố nội tiết tố (như hormone giới tính và mang thai), cũng như tình trạng viêm của da, ở những người dễ bị mắc có tính di truyền. Cơ sở di truyền của nám da được hỗ trợ bởi sự xuất hiện của nó ở những người họ hàng cấp một, được báo cáo khoảng 41–61% số bệnh nhân ở Brazil, bao gồm cả chị em sinh đôi giống nhau, trong khi tỷ lệ phổ biến dự kiến chung ở người lớn trong cùng khu vực là 16–28%. Nám có yếu tố gia đình có liên quan đến diễn tiến kéo dài và giảm khả năng gây ra bởi các biện pháp tránh thai bằng hormone [2–5].
Sắc tố da tuân theo kiểu di truyền đa gen, điều này giải thích sự khác biệt về kiểu hình ở các loài động vật có vú và các nhóm quần thể người. Tuy nhiên, không có mô hình động vật nào về nám, mặc dù tăng sắc tố sau viêm có thể được gây ra ở các loài khác [6].
Một đánh giá 67 gia đình người Brazil bị nám, sử dụng một mô hình phân tách phức tạp, đã chứng minh một thành phần di truyền (gen chính) tuân theo sự di truyền trội trên nhiễm sắc thể thường [7]. Một số quần thể, bao gồm người Trung Đông, Đông Á, Ấn Độ, người Mỹ gốc Phi và người Mỹ Latinh, bị ảnh hưởng bởi nám nhiều hơn những người khác, chẳng hạn như người Bắc Âu, thổ dân Úc, người da đỏ Mỹ và quần thể từ châu Phi cận Sahara. Một nghiên cứu về nguồn gốc bộ gen cho thấy phụ nữ Brazil có nguồn gốc hỗn hợp hoặc có gen liên quan đến tổ tiên người châu Phi bị ảnh hưởng nhiều hơn bởi nám trên mặt [8].
Một phân tích phiên mã so sánh nám da mặt và vùng da lân cận đã xác định được 279 gen biểu hiện khác nhau. Các gen liên quan đến quá trình tạo melanin (TYR, TYRP1 và MLANA) và sự chuyển giao các melanosome (Myosin5a và GDA) được điều hoà tăng trong nám da, cũng như các gen liên quan đến một phân nhóm các yếu tố điều biến con đường Wnt/b-catenin (Wnt5a, sFRP2, LGR5, và WIF1), prostaglandin (PTGIS và PTGS1), sửa chữa (SER-PINB3) và tạo mạch (angiopoietin-like 1 và 2, heparanase và MMP2). Ngược lại, các gen liên quan đến chuyển hóa lipid (PPARa, ALOX15B, DGAT2L3 và PPARGC1A) và VEGFA được điều hòa giảm [9].
Một phân tích phiên mã khác xác định được 334 gen biểu hiện khác nhau. Các gen liên quan đến con đường kích hoạt thụ thể kích hoạt bằng chất tăng sinh peroxisome (PPAR) (ADIPOQ, FABP4, PLIN1 và LPL) được điều hòa giảm, nhưng GDA và INA, liên quan đến sự hình thành đuôi gai của melanocyte, được điều hòa tăng, cũng như các gen liên quan đến chức năng của lớp sừng. (S100A8, SPRR2A, SPRR2B và KLK6) và những chất liên quan đến quá trình tạo melanin (TYR, TYRP1 và sFRP2), ức chế sự thoái hóa tyrosine (NQO1) và PDZK1, có thể làm trung gian cho quá trình tạo melanin do estrogen [10].
Một so sánh về nám da mặt ở vùng da sau tai cho thấy sự điều hòa giảm của H19. Mặc dù phiên mã RNA không mã hóa, nhưng nuôi cấy hỗn hợp (melanocyte–keratinocyte) suy giảm H19 chứng minh sự gia tăng quá trình tạo melanin và chuyển melanin sang tế bào sừng, trong khi các melanocyte trong môi trường nuôi cấy đơn thì không, và các nuôi cấy hỗn hợp có H19 suy giảm được điều trị bằng estrogen cho thấy sự gia tăng biểu hiện tyrosinase [11]. Hơn nữa, biểu hiện thấp hơn của miR-675, một micro-RNA H19 (miRNA) nhắm vào MITF, được tìm thấy ở da bị nám và miR675 đã được chứng minh là nhắm vào cadherin-11 (CDH11), có biểu hiện trong nguyên bào sợi và tế bào sừng gây ra tổn thương trong màng đáy (BM) và sự hình thành melanin [12]. Ngoài ra còn có sự điều hòa tăng của gen PDZK1 trong bệnh nám da. PDZK1 là thành viên của nhóm yếu tố điều hòa trao đổi chất Na+/H+ và dẫn đến tăng sinh melanin và chuyển giao melanosome sang tế bào sừng [13].
Cơ quan điều hoà mạnh nhất quá trình tạo eumelani là thụ thể melanocortin loại 1 (MC1R), được phiên mã từ một gen đa hình cao chịu trách nhiệm về nhiều kiểu hình của màu da và tóc, cũng như độ nhạy cảm của da với bức xạ cực tím [14]. Trong nám da, tính đa hình của MC1R, được đặc trưng bởi sự thay thế guanosine cho adenosine ở codon 92 (Val92Met), phổ biến ở phụ nữ Java khi so sánh với nhóm chứng [15].
Nuôi cấy nguyên bào sợi ban đầu từ vết nám trên khuôn mặt và vùng da lân cận đã cho thấy sự điều hòa tăng của các gen WNT3A, EDN3, ESR2, PTG2, MMP1 và SOD2 cũng như sự điều hòa giảm của COL4A1, CSF2, DKK3, COL7A1, TIMP4, CCL2 và CDH11 trong nám da. Những gen này có liên quan đến các yếu tố tiền viêm sinh melanin và sửa chữa khiếm khuyết, tương ứng với một kiểu hình có thể góp phần trong tổn thương lớp bì nông và sự hình thành melanin kéo dài [16].
Tất cả những phát hiện này chứng minh nám da là một rối loạn đa yếu tố xuất hiện ở những người nhạy cảm về mặt di truyền. Các nghiên cứu sâu hơn sẽ chứng minh khả năng sàng lọc chính xác đối với những cá nhân như vậy để có thể phát hiện sớm và thực hiện các biện pháp phòng ngừa nghiêm ngặt.
BỨC XẠ ÁNH SÁNG MẶT TRỜI
Vì nám chỉ xảy ra ở vùng da tiếp xúc với ánh sáng, khởi phát muộn ở những vùng da sẫm màu hơn, nặng hơn sau khi tiếp xúc với ánh nắng mặt trời và phổ biến hơn ở các quốc gia nhiệt đới, nên việc tiếp xúc với ánh nắng mặt trời được coi là yếu tố môi trường quan trọng nhất trong cơ chế bệnh sinh của nó [4].
Bất kỳ bức xạ nào cũng có thể tương tác với mô sinh học, có tác động thay đổi theo bước sóng, cường độ, độ xuyên qua da, mức độ phơi nhiễm và tính nhạy cảm của từng cá nhân (chẳng hạn như loại da và vị trí cơ thể). Tuy nhiên, trong nám, vai trò chính xác của các bước sóng khác nhau và tác động của sự kết hợp của chúng vẫn chưa được hiểu rõ hoàn toàn. Bức xạ tia cực tím (UVR) kích thích trực tiếp quá trình tạo melanin trong melanocyte và ảnh hưởng đến keratinocyte, tế bào mast (mast cell, MC) và nguyên bào sợi, là những tế bào điều chỉnh cận tiết quá trình tạo melanin. Tuy nhiên, các tác động khác nhau được tạo ra trên da bởi bức xạ có các bước sóng khác nhau [17].
UVB có tác dụng chính trên lớp biểu bì và màng đáy, trong khi UVA mở rộng đến lớp bì nông. Tiếp xúc lâu dài với tia UV dẫn đến lão hóa da, stress oxy hóa và viêm góp phần vào quá trình hình thành melanin kéo dài được quan sát thấy ở nám da [18]. Nó cũng gây ra sự biểu hiện của p53 trong tế bào sừng, thúc đẩy quá trình tổng hợp propiomelanocortin [như hormone vỏ thượng thận (ACTH), yếu tố kích thích tế bào hắc tố (melanocyte stimulating factor, MSH) và b- endorphin] và laminin-332 kích thích cận tiết sự hình thành melanin [19]. UVB làm tăng hoạt động của các melanocyte, dẫn đến việc chuyển giao melanosome sang tế bào sừng hiệu quả hơn [20]. Nó cũng góp phần làm thoái hoá chuỗi heparan sulfat trong màng đáy, tăng cường chuyển các chất kích thích tạo melanin từ lớp bì sang lớp biểu bì [21]. Cuối cùng, UVB gây giải phóng các chất trung gian gây viêm, như prostaglandin và yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor, VEGF), kích thích tăng sinh nội mô. Ngoài ra, các neuropeptide như peptide liên quan đến gen calcitonin (CGRP) kích hoạt quá trình tạo melanin và đuôi gai của melanocyte, được thúc đẩy bởi UVR [22].
So với UVB, UVA ít gây đỏ da hơn, nhưng lại hiệu quả hơn trong việc gây sạm da (ngay tức thời và kéo dài) và làm rám nắng kéo dài, đặc biệt là ở những người có làn da sẫm màu [17]. Không giống như UVB, tác động của UVA lên các phân tử sinh học chính của da là không trực tiếp. Năng lượng được hấp thụ bởi các chromophore được chuyển đổi để tạo ra các loại phản ứng dẫn đến stress oxy hóa [23]. Ngoài da, tiếp xúc với tia UVA cũng có thể gây ra stress oxy hóa toàn thân [24].
Tia UV gây ra sự giải phóng endothelin, oxit nitric, leukotrienes và prostaglandin ở biểu bì, thúc đẩy sự gia tăng các đuôi gai của melanocyte và điều hòa tăng gen TYR [25, 26]. Ở lớp bì nông, các nguyên bào sợi giải phóng một số yếu tố tạo melanin hòa tan như yếu tố tăng trưởng tế bào sừng (keratinocyte growth factor, KGF), interleukin (IL)-6, yếu tố hoại tử khối u (tumor necrosis factor, TNF)-a, yếu tố tế bào gốc (stem cell factor, SCF), yếu tố tăng trưởng nguyên bào sợi cơ bản (basic fibroblast growth factor, bFGF) , yếu tố tăng trưởng tế bào gan (hepatocyte growth factor, HGF) và yếu tố kích thích đại thực bào bạch cầu hạt (granulocyte macrophage colony-stimulating factor, GM-CSF) và sản xuất protein sFRP2, điều chỉnh con đường Wnt/bcatenin, có liên quan đến quá trình tạo melanin [27]. Tiếp xúc với ánh nắng mặt trời lâu dài cũng gây ra một kiểu hình lão hóa trong nguyên bào sợi, với sự bài tiết tích cực của các yếu tố tạo melanin và tiền viêm [28]. Tế bào mast thoái hóa dưới các kích thích nhiệt, vật lý và tia UV, giải phóng các chất trung gian hoạt tính sinh học thúc đẩy hình thành melanin và góp phần gây tổn thương cho lớp bì nông và màng đáy [29]. So với nhóm đối chứng khỏe mạnh phù hợp với độ tuổi và kiểu hình, phụ nữ bị nám có liều ban đỏ do UVB và UVA gây ra thấp hơn, cho thấy kiểu hình nhạy cảm với tia UV [30].
Ánh sáng khả kiến (visible light, VL) là bức xạ không ion hóa xuyên qua lớp bì sâu và lớp dưới da. Sự tạo sắc tố chỉ được ghi nhận trong các kiểu da tối màu hơn (III–VI) sau khi tiếp xúc với ánh sáng khả kiến liều cao và chỉ các bước sóng ngắn hơn (420–470 nm, xanh lam và tím) mới có thể tạo ra sắc tố thông qua việc kích hoạt thụ thể opsin 3 (OPN3) trong melanocyte [31]. Mặc dù OPN3 không biểu hiện quá mức ở vùng da bị nám so với vùng da lân cận, nhưng việc sử dụng kem chống nắng có màu (với oxit sắt), ngăn chặn các bước sóng ánh sáng khả kiến ngắn, giúp tăng cường tác dụng làm giảm sắc tố của hydroquinone và cản trở quá trình hình thành sắc tố gây nám vào mùa hè [32,33].
Có tác dụng hiệp đồng của UVA bước sóng dài và ánh sáng khả kiến đối với sắc tố da và ban đỏ [34]. Trong các hoạt động thông thường hàng ngày, UVA và ánh sáng khả kiến là loại bức xạ mặt trời mà các cá nhân tiếp xúc nhiều nhất. Tuy nhiên, không có kem chống nắng thương mại nào cung cấp sự bảo vệ đầy đủ trong phạm vi này. Ngay cả kem chống nắng có chứa oxit sắt cũng cho thấy sự giảm hấp thụ bức xạ từ 400 nm [33].
Trong các mẫu da mặt chịu liều gây melanin tối thiểu của UVB, UVA và ánh sáng khả kiến, không có sự khác biệt về sự gia tăng mật độ melanin biểu bì đối với mỗi bước sóng giữa vùng da bị nám và vùng da liền kề. Tuy nhiên, sự hình thành hạt thô của melanin ở biểu bì và mật độ cao hơn của melanin ở lớp bì nông được chứng minh ở vùng da bị nám sau khi chiếu tia UVA [35].
Bức xạ tia UVA, UVB và xanh lam liều thấp tiếp xúc trong các hoạt động thông thường trong nhà cách xa cửa sổ và ánh sáng từ đèn trong nhà và các thiết bị điện tử không liên quan đến sắc tố da [35–37].
Tia hồng ngoại (IR) là bức xạ không ion hóa chiếm một nửa quang phổ mặt trời và được coi là nhiệt [38]. Khả năng gây ban đỏ và sắc tố da của nó được chứng minh trong ban đỏ ab igne [39]. Tiếp xúc tia hồng ngoại đã được chỉ ra là nguyên nhân của sự kích hoạt chất nền metallicoproteinase 1 (MMP1), giãn mạch, giải phóng cytokine tiền viêm, gây độc tế bào trực tiếp và tăng stress oxy hóa và tổn thương DNA, dẫn đến lão hóa do ánh sáng. Đáng chú ý, hầu hết các nghiên cứu về tác động của bức xạ hồng ngoại trên da đã được thực hiện trong ống nghiệm, sử dụng các lần phơi nhiễm đơn lẻ với các nguồn nhân tạo, không giống với kiểu phơi nắng hàng ngày trong đời thực [17]. Cho đến nay, không có đánh giá hệ thống nào xem xét vai trò của bức xạ hồng ngoại mặt trời đối với nám da. Tuy nhiên, một cuộc khảo sát gần đây cho thấy mối liên quan giữa mức độ nghiêm trọng của bệnh và việc tiếp xúc với nhiệt độ do nghề nghiệp [40].
Yếu tố quan trọng nhất gây ra sự phát triển và làm trầm trọng thêm nám da là do tiếp xúc với ánh nắng mặt trời hàng ngày, đặc biệt là do không thể ngăn chặn hoàn toàn tất cả các bức xạ mặt trời liên quan đến quá trình hình thành melanin (UVB, UVA và ánh sáng khả kiến) do sử dụng kem chống nắng không đạt yêu cầu trong các tình huống thực tế [41].
KÍCH THÍCH NỘI TIẾT
Hormone sinh dục nữ là yếu tố nguy cơ nổi tiếng đối với sự phát triển của nám da và nó chiếm ưu thế ở phụ nữ có khả năng sinh sản củng cố giả thuyết này. Mất cân bằng nội tiết tố do mang thai, khối u buồng trứng, liệu pháp thay thế nội tiết và thuốc tránh thai nội tiết kích thích sự hình thành melanin [42]. Tuy nhiên, tỷ lệ nám da do kích thích nội tiết tố khác nhau: 14,5–56% trường hợp nám da xảy ra ở phụ nữ mang thai, trong khi 11–46% có liên quan đến việc sử dụng biện pháp tránh thai nội tiết [2, 4, 5, 43, 44].
Hiện nay không có đủ thông tin về vai trò của nồng độ hormone huyết thanh ở bệnh nhân bị nám và các nghiên cứu khác nhau đã đưa ra kết quả trái ngược nhau. Nồng độ estradiol, hormone tạo hoàng thể (luteinizing hormone, LH), hormone kích thích nang trứng (follicle-stimulating hormone, FSH) và prolactin trong huyết thanh trong chu kỳ kinh nguyệt sớm tăng ở phụ nữ Ấn Độ bị nám so với nhóm chứng [45]. Tương tự, nồng độ estradiol ở phụ nữ Pakistan bị nám cao hơn so với nhóm chứng [46]. Tuy nhiên, nồng độ testosterone, LH, triiodothyronine tự do (fT4), hormone kích thích tuyến giáp (TSH), estradiol và progesterone trong huyết thanh thấp hơn đã được tìm thấy ở phụ nữ Ấn Độ bị nám da so với nhóm chứng, mặc dù không có nồng độ hormone nào tương quan với mức độ nghiêm trọng của nám [47]. Ở Puerto Rico, so sánh phụ nữ bị nám da với nhóm chứng cho thấy nồng độ estradiol thấp hơn nhưng nồng độ LH cao hơn ở phụ nữ bị nám da [48].
Ngoài hormone buồng trứng và nhau thai, quá trình mang thai thúc đẩy sản xuất hormone tuyến yên, bao gồm LH, FSH và MSH, dẫn đến phiên mã tyrosinase và dopachrom tautomerase, làm tăng sắc tố sinh lý và nám, chủ yếu trong tam cá nguyệt thứ ba [49].
Sử dụng hormone, bao gồm cả estrogen tại chỗ, đã được báo cáo là gây ra nám da [50]. Liệu pháp thay thế hormone trong thời kỳ mãn kinh có liên quan đến nám da ngoài mặt [51]. Tuy nhiên, một nghiên cứu ở Brazil trên những phụ nữ bị nám da ngoài mặt và nhóm chứng cho thấy không có mối liên hệ nào với thời kỳ mãn kinh, uống thuốc tránh thai, mang thai hoặc liệu pháp thay thế hormone [52].
Nám da ở nam giới lần đầu tiên được báo cáo sau suy sinh dục, với nồng độ LH và FSH cao và testosterone thấp [53]. Một nam thanh niên bị nám da mặt sau khi uống chất kích thích tuyến sinh dục làm tăng nồng độ LH [54]. Một nam thanh niên khác bị nám da liên quan đến việc sử dụng finasteride để điều trị chứng rụng tóc nội tiết tố nam, làm giảm nồng độ dihydrotestosterone (DHT) nhưng lại làm tăng testosterone có sẵn cho chuyển đổi ngoại biên thành estrogen [55].
Nồng độ LH cao hơn và testosterone thấp hơn đã được chứng minh ở nam giới Ấn Độ bị nám so với nhóm chứng [56]. Tuy nhiên, một nghiên cứu so sánh khác không tìm thấy sự khác biệt về nồng độ LH, FSH, TSH, testosterone, progesterone, estradiol, MSH hoặc dehydroepiandrosterone sulfate (DHEAS) [57].
Estrogen và progesterone có liên quan đến nám vì tác động của chúng lên da được điều hòa bởi các thụ thể nhân, chẳng hạn như thụ thể estrogen-a (ER1) và ß (ER2) và thụ thể progesterone (PR) [58]. Ở da mặt, ER2 phân bố rộng hơn ER1, ngược lại ở vú và bụng [59]. Mặc dù cả hai thụ thể đều có ái lực với estradiol, nhưng chúng tạo ra các phản ứng tế bào khác nhau liên quan đến quá trình chuyển đổi từ biểu mô sang trung mô bằng con đường gen và không gen [60].
Estradiol thúc đẩy sự tăng sinh biểu mô thông qua quá trình phosphoryl hóa kinase điều hòa tín hiệu ngoại bào (ERK)1-2/ kinase protein kích hoạt bằng mitogen (MAP) và kích hoạt con đường Wnt/b-catenin trong tế bào sừng [61]. Hơn nữa, estrogen dẫn đến tăng sản xuất KGF ở biểu mô, điều này cũng kích thích quá trình hình thành melanin [62].
Estradiol ảnh hưởng đến độ dày của da bằng cách kích thích nguyên bào sợi và tổng hợp collagen [63]. Estrogen trực tiếp làm trung gian cho quá trình tạo melanin thông qua kích hoạt ER2 trong melanocyte. Các melanocyte ở người được nuôi cấy với estrogen cho thấy biểu hiện MC1R tăng lên, thúc đẩy quá trình điều hòa tăng MITF, TRP1 và TRP2 thông qua việc ngăn chặn protein kinase A (PKA). Tuy nhiên, việc bổ sung chất đối kháng ER2 sẽ ức chế quá trình tạo melanin [11].
So với vùng da lân cận, vùng da bị nám thể hiện sự gia tăng biểu hiện của ER2 ở lớp biểu bì và nguyên bào sợi ở phần bì nông [16, 64].
Vai trò của progesterone và PRs trong quá trình hình thành melanin và tăng sinh melanocyte là trái ngược nhau [65, 66]. Ở da bị nám, biểu hiện PR biểu bì tăng lên so với vùng da lân cận [64]. Tuy nhiên, progesterone không có tác dụng đối với hoạt động của tyrosinase và đã chứng minh, sau khi tiếp xúc tia UV, tác dụng ức chế tăng sinh của melanocyte và quá trình tạo hắc tố qua trung gian estrogen [66].
Liên quan đến những thay đổi nội tiết khác, bất thường tuyến giáp có liên quan đến nám da. Tuy nhiên, kết quả của những nghiên cứu như vậy đang gây tranh cãi và không có nghiên cứu nào được thực hiện với một phương pháp phù hợp để hỗ trợ một giả thuyết hợp lý về những thay đổi này trong cơ chế bệnh sinh của nám.
Tỷ lệ rối loạn tuyến giáp ở phụ nữ Brazil bị nám da tương tự như dự đoán theo độ tuổi [2]. Trong số những bệnh nhân Ấn Độ bị nám da mặt, chỉ có 7,5% báo cáo bị suy giáp trong khi 0,9% báo cáo mắc hội chứng buồng trứng đa nang [40].
So sánh phụ nữ Iran bị nám da với nhóm chứng cho thấy không có sự khác biệt về nồng độ TSH và thyroxine (T4) nhưng tỷ lệ bất thường về nồng độ triiodothyronine (T3) ở nhóm bị nám da cao hơn [67]. Một nghiên cứu khác ở Iran so sánh giữa phụ nữ bị nám và đối chứng, không tìm thấy sự khác biệt về mức TSH hoặc T4, nhưng mức độ bất thường của T3 và kháng thể kháng peroxidase tuyến giáp (TPO) thường được xác định hơn ở nhóm bị nám [68].
Một nghiên cứu ở phụ nữ Brazil bị nám cho thấy không có bất thường về hormone tuyến giáp (TSH và fT4), prolactin, estradiol, FSH hoặc LH [69]. Tuy nhiên, một nghiên cứu cắt ngang ở Thổ Nhĩ Kỳ đánh giá phụ nữ bị nám và đối chứng cho thấy nồng độ TSH, fT4 và kháng thể kháng thyroglobulin cao hơn ở người bị nám [70].
Một nghiên cứu của Iran so sánh phụ nữ bị nám và đối chứng không tìm thấy sự khác biệt về LH, FSH, DHEAS, prolactin, testosterone hoặc 17- hydroxyprogesterone, nhưng tỷ lệ u nang buồng trứng cao hơn được ghi nhận ở nhóm bị nám [71].
Những kết quả gây tranh cãi này liên quan đến kích thích nội tiết có thể là do thực tế là hầu hết các nghiên cứu cắt ngang và hàng loạt trường hợp đã được tiến hành sau khởi phát nám, khi sự mất cân bằng nội tiết gây ra bệnh không thể được mô tả đồng bộ. Hơn nữa, nám da có thể tiến triển từ tình trạng quá mẫn cảm tại chỗ để gây ra các tác động nội tiết, mà không phải là kết quả của rối loạn nội tiết.
Các kích thích nội tiết, đặc biệt là estrogen, có liên quan đến cơ chế bệnh sinh của nám và hệ thống sắc tố nhạy cảm với một số hormone. Tuy nhiên, vai trò của sự nhạy cảm tại chỗ đối với sự thay đổi nội tiết trong nám vẫn chưa được xác định rõ ràng, mặc dù nó là nền tảng cho sự phát triển của các biện pháp can thiệp dựa trên nội tiết ở những bệnh nhân này.
TÌNH TRẠNG OXY HÓA
Tiếp xúc với các tác nhân gây stress oxy hóa (như tia UV, ô nhiễm không khí, vận động thể chất và thiếu ngủ), ngay cả trong điều kiện bình thường, có thể tạo ra các loại oxy phản ứng (reactive oxygen specie, ROS) trong da. Tuy nhiên, một số cơ chế chống oxy hóa sinh lý có thể trung hoà tác động của chúng [72].
Quá trình peroxy hóa lipid của màng tế bào là một trong những con đường chính gây tổn thương mô do stress oxy hóa, và malondialdehyd (MDA) là sản phẩm cuối cùng của cơ chế này. Tuy nhiên, một số chất chống oxy hóa có thể ức chế tổn thương oxy hóa do các gốc tự do gây ra [73]. Một mối tương quan tỷ lệ nghịch mạnh được thấy giữa glutathione huyết tương (GSH) và mức độ nghiêm trọng của nám, cho thấy rằng nó đại diện cho tình trạng stress oxy hóa cao, dẫn đến sự suy giảm GSH [74]. Nồng độ superoxide dismutase (SOD) và hoạt tính peroxidase GSH trong huyết tương cao hơn ở những bệnh nhân bị nám da so với nhóm chứng, nhưng nồng độ carbonyl lại thấp [75]. Nồng độ MDA trong huyết thanh cũng cao ở những bệnh nhân bị nám. Ngoài ra, có một mối tương quan giữa nồng độ MDA huyết thanh và mức độ nghiêm trọng lâm sàng của nám [76].
Synthase oxit nitric cảm ứng (iNOS) là nguồn chính của oxit nitric (NO) trong nám và các rối loạn viêm khác. UVB kích thích con đường phosphatidylinositol 3-kinase/Akt và yếu tố nhân kappa-light-chain-enhancer của tế bào B hoạt hóa (NF-jB), gây ra biểu hiện iNOS trong tế bào sừng, dẫn đến kích hoạt paracrine NO của tyrosinase trong melanocyte. Ở da bị nám, iNOS được biểu hiện quá mức ở tế bào sừng ở lớp đáy so với vùng da lân cận [77, 78].
Bên cạnh vai trò là chất điều hoà chính của nhịp sinh học và là chất xử lý mạnh mẽ các gốc tự do, melatonin còn là một chất chống oxy hóa gián tiếp. Nó ổn định màng tế bào, làm cho chúng có khả năng chống lại tổn thương oxy hóa cao hơn bằng cách kích thích các enzyme chống oxy hóa khác, chẳng hạn như SOD, glutathione peroxidase và GSH reductase. Melatonin cũng ức chế quá trình tổng hợp iNOS qua trung gian tia UV và nó có thể ảnh hưởng đến quá trình chuyển hóa MSH, estrogen và progesterone [79]. Nồng độ melatonin và catalase trong huyết thanh thấp hơn ở những bệnh nhân bị nám so với nhóm chứng, trong khi nồng độ protein carbonyl và NO trong huyết thanh cao hơn [80]. Đáng chú ý, một báo cáo ban đầu đã chỉ ra kết quả đầy hứa hẹn sau khi sử dụng melatonin tại chỗ và đường uống trong điều trị nám da [81]. Cuối cùng, vì rối loạn giấc ngủ góp phần gây ra stress oxy hóa và rối loạn điều hòa melatonin, nên việc nghiên cứu rối loạn giấc ngủ trong nám da là cần thiết, và melatonin nên được nghiên cứu như một chất bổ trợ tiềm năng trong điều trị nám da [82].
Lớp bì nông của da bị ảnh hưởng bởi nám biểu hiện các dấu hiệu của stress oxy hóa, chẳng hạn như sự biểu hiện quá mức của p38, so với vùng da lân cận [83]. Hơn nữa, melanin giải phóng ROS sau khi tiếp xúc với ánh nắng mặt trời, và quá trình tạo melanin là một quá trình oxy hóa nội bào [84]. Một số phương pháp điều trị nám hiệu quả là các chất chống oxy hóa, như bôi ngoài da vitamin C, niacinamide, cysteamine, axit kojic, axit phytic và pycnogenol đường uống [85]. Những phát hiện này thúc đẩy việc nghiên cứu các cơ chế dẫn đến sự mất cân bằng oxy hóa trong nám để khám phá các chiến lược điều trị và phòng ngừa.
Stress oxy hóa là hậu quả cuối cùng của một số dạng tổn thương và cũng có thể là kết quả của sự thất bại của hệ thống chống oxy hóa. Trong bệnh nám da, stress oxy hóa tại chỗ hoặc toàn thân có thể được nhận biết và có liên quan đến mức độ nghiêm trọng của bệnh, nhưng kiến thức chính xác về các yếu tố dẫn đến stress oxy hóa (tại chỗ và toàn thân) có thể đưa đến sự phát triển của các biện pháp can thiệp hiệu quả nhắm vào cơ chế bệnh sinh của bệnh này.
THAY ĐỔI CHỨC NĂNG
Da bị nám biểu hiện một số thay đổi về chức năng vượt quá những thay đổi của da bị lão hóa ánh sáng và ảnh hưởng đến cân bằng nội môi của da. Chỉ số melanin, chỉ số ban đỏ và độ pH ở da bị nám cao hơn so với vùng da tiếp xúc với ánh sáng lân cận. Tuy nhiên, không có đặc tính sinh lý da nào khác biệt giữa cái gọi là nám biểu bì, nám trung bì và nám hỗn hợp.
Hàng rào bảo vệ da bị tổn thương khi bị nám, như lớp sừng (stratum corneum, SC), mặc dù ngậm nước nhiều, nhưng lại mỏng hơn so với da xung quanh tổn thương. Sự mất nước qua biểu bì (transepidermal water loss, TEWL) và lượng bã nhờn không khác nhau giữa da bị nám và da lân cận. Tuy nhiên, sau tổn thương da do lột băng dán, TEWL được phát hiện tăng lên ở vùng da bị nám trong khi quá trình phục hồi hàng rào bị chậm [86].
Lớp sừng mỏng đi là một phát hiện phổ biến ở da bị lão hóa do ánh sáng và nó tương quan với việc phục hồi hàng rào bảo vệ da bị chậm, như thấy ở bệnh nám da [87]. Phát hiện này trái ngược với dự đoán ở những người có da sẫm màu hơn, thể hiện khả năng phục hồi hàng rào tốt hơn, lớp sừng dày hơn, và độ pH thấp hơn so với da trắng [88].
Nói chung, tổng lipid, phosphatidic acid, phosphatidylserine và ceramides tăng lên trong nám da, có thể là một cơ chế bù trừ để duy trì chức năng hàng rào bảo vệ da. Hơn nữa, một số lipid quan trọng có biểu hiện thấp với khả năng kích hoạt melanocyte cao, cho thấy rằng việc sửa chữa hàng rào bảo vệ da bị tổn thương có thể là một phương pháp điều trị bổ sung hiệu quả cho bệnh nám da [89].
Sự sản xuất melanin ở người là một quá trình phức tạp được trung gian bởi các kích thích paracrine, autocrine và môi trường, liên quan đến hàng trăm gen và một số con đường truyền tín hiệu hoạt động ở cấp độ phiên mã và hậu phiên mã. Tuy nhiên, những điều phức tạp này nằm ngoài phạm vi của bài này [90]. Liên quan đến nám, một số con đường tạo melanin duy trì sắc tố da đã được đề xuất (Hình 1a).
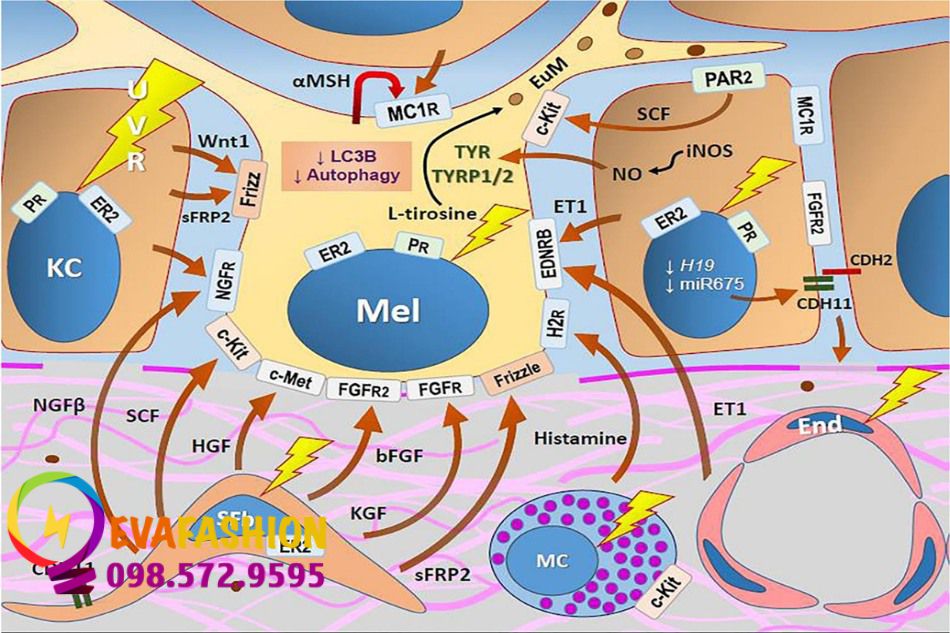
Melanocytes (Mels) tăng chức năng, thúc đẩy tạo thành eumelanin (Eum) do kích thích paracrine và autocrine. Tia UV gây ra các phản ứng tạo melanin, oxy hóa và đáp ứng viêm ở lớp biểu bì và lớp bì nông. Melanocortin (aMSH) và thụ thể của nó (MC1R) được tăng lên trong keratinocytes (KCs) và Mels. Các kích thích nội tiết làm trung gian quá trình tạo melanin thông qua các thụ thể nhân của estrogen-b (ER2) và progesterone (PR). Một số yếu tố tăng trưởng, cũng là chất gây tạo melanin, được giải phóng tích cực bởi các nguyên bào sợi lão hoá (senescent fibroblasts, SFbs), bao gồm yếu tố tăng trưởng thần kinh loại b (NGFb), SCF, HGF, bFGF, KGF và sFRP2. Endothelin-1 (ET1) được tiết ra bởi nội mô (End) và KC sau khi tiếp xúc với tia UV. Tế bào mast (MCs) giải phóng histamine dưới sự kích thích cận tiết và tia UV. Thụ thể được kích hoạt bởi protease-2 (PAR2) kích thích sự hình thành đuôi gai của melanocyte và quá trình thực bào melanosome bởi KC và thúc đẩy sự giải phóng SCF. Trong bệnh nám da, Mels biểu hiện suy giảm sự tự thực bào (giảm protein liên kết với microtube LC3B– chuỗi nhẹ 1A/1B 3B), kích thích quá trình tạo melanin. Ngoài ra, biểu hiện thấp hơn của miR-675, micro-RNA nhắm mục tiêu MITF, có liên quan đến biểu hiện cao hơn của cadherin-11 (CDH11) trong KC và nguyên bào sợi, góp phần gây tổn thương màng đáy và lớp bì nông. Oxit nitric (NO), được tạo ra bởi synthase nitơ oxit cảm ứng (iNOS) và Wnt1, được tăng lên trong lớp biểu bì trong nám.
MC1R, tăng trong melanocyte và keratinocyte trong nám da, và chủ vận của nó hormone kích thích tế bào hắc tố a-melanocyte (a-MSH) chứ không phải là đối vận của nó protein tín hiệu agouti (ASIP), được tiết ra bởi lớp biểu bì [83]. Kích hoạt MC1R dẫn đến phiên mã một số gen, bao gồm MITF, yếu tố điều hòa chính của quá trình tạo melanin, kiểm soát sự biểu hiện của các enzyme, như tyrosinase, protein liên quan tyrosinase 1 (TYRP1) và TYRP2 [90]. Do đó, các phương pháp điều trị nám cổ điển (như hydroquinone và thiamidol) nhắm mục tiêu ức chế tyrosinase, nhưng quá trình tạo melanin thể hiện sự kết thúc của một quá trình phức tạp bên dưới, điều này có thể giải thích cho tái phát bệnh thường xuyên [91].
Một số yếu tố tăng trưởng có hoạt tính sinh melanin được tiết ra bởi keratinocyte và nguyên bào sợi trong nám da. Tia UV kích thích nguyên bào sợi giải phóng HGF, NGFb, SCF và bFGF [92]. Các nghiên cứu in vitro tìm thấy sự tích tụ melanin trong keratinocyte lớp đáy khi mô biểu bì được ấp với nguyên bào sợi đã được xử lý bằng tia UV, cho thấy vai trò tạo sắc tố của nguyên bào sợi trong nám [92]. Biểu hiện SCF tăng ở lớp bì bị nám so với lớp bì không bị tổn thương; mặc dù không có sự khác biệt trong các lớp biểu bì này, c-KIT tăng lên trong lớp biểu bì của nám [26]. Hơn nữa, KGF do nguyên bào sợi tiết ra tích tụ trong lớp biểu bì của vùng da bị nám [93].
Con đường Wnt/b-catenin tham gia vào quá trình di cư và tăng sinh nguyên bào hắc tố (melanoblast), đồng thời tạo ra sắc tố [94]. Wnt1 là chất kích hoạt chính của nó thông qua thụ thể bị xáo trộn và thúc đẩy sự tích lũy và ổn định b- catenin [95]. Có biểu hiện biểu bì của Wnt1 ở da bị nám nhiều hơn ở vùng da khỏe mạnh liền kề hoặc vùng được bảo vệ ánh sáng; ngoài ra, Wnt1 tương quan với mật độ tế bào mast ở lớp bì nông [1]. Ngoài ra, sFRP2 được biểu hiện quá mức trong lớp biểu bì và xung quanh các nguyên bào sợi trong nám da [27].
PAR2 là thành viên của họ thụ thể kết hợp với protein G và được kích hoạt bởi các kích thích khác nhau, chẳng hạn như MC tryptase, KGF, a- MSH, yếu tố VIIa và yếu tố Xa. Việc kích hoạt thụ thể PAR2 trong tế bào sừng làm trung gian chuyển giao melanosome và tăng sản xuất SCF, dẫn đến tổng hợp melanin [90].
Endothelin là chất co mạch mạnh được sản xuất bởi các tế bào nội mô và keratinocyte sau khi tiếp xúc tối thiểu với tia UV [96]. Chúng trực tiếp tạo ra melanin bằng cách liên kết với thụ thể endothelin B (EDNRB), một thụ thể đặc hiệu trên melanocyte [97]. Sự biểu hiện của EDRNB và c-KIT trong melanocyte cũng được gây ra bởi UVB [96]. Endothelin-1 (ET1), chứ không phải các yếu tố khác được tiết ra bởi các tế bào nội mô lớp bì như NO, leukotrienes và VEGF, đã được chỉ ra là chất trung gian chịu trách nhiệm kích hoạt các con đường truyền tín hiệu trong quá trình tạo melanin. EDNRB kích hoạt chuỗi phosphoryl hóa enzyme của yếu tố phiên mã liên quan đến microphthalmia (MITF), gây ra sự điều hòa tăng tyrosinase và dopachrom tautomerase thông qua kinase protein hoạt hóa bằng mitogen (MAPKs), ERK1/2 và p38 [97]. Vai trò của endothelin và kích hoạt PAR2 trong nám vẫn chưa được làm rõ, mặc dù axit tranexamic làm giảm ET1 trong nám.
Biểu hiện của cyclooxygenase-2 (COX-2) do tia UV gây ra thúc đẩy quá trình tổng hợp PGE2 bởi tế bào sừng, làm trung gian cho tình trạng viêm da và tăng sinh tế bào. Các nghiên cứu in vitro đã chỉ ra rằng việc loại bỏ COX-2 trong melanocyte làm giảm biểu hiện của tyrosinase, TRP-1, TRP-2, gp100 và MITF, đồng thời làm giảm hoạt động của enzyme tyrosinase [98]. Tuy nhiên, vẫn chưa có bằng chứng chứng minh sự biểu hiện khác biệt của PGE2 như một yếu tố gây bệnh chính trong nám da [83].
Autophagy (tự thực bào) là một quá trình tế bào chất dị hóa làm thoái hoá các protein bất thường và các đại phân tử bị hư hỏng [99]. Nó có thể được gây ra bởi tình trạng đói, thiếu oxy, stress oxy hóa và phơi nhiễm tia UV [99]. Sự tham gia của quá trình tự thực trong sắc tố da được đề xuất bới bằng chứng về sự tự thực bị suy yếu trong quá trình lão hóa da sớm [99]. Hơn nữa, có sự khác biệt trong hoạt động tự thực liên quan đến tổ tiên, và các tế bào sừng từ các cá nhân da trắng thể hiện hoạt động tự thực cao hơn so với các tế bào từ các cá nhân người Mỹ gốc Phi [100]. Trong nuôi cấy tế bào, các melanocyte suy giảm sự tự thực giữ lại các melanosome trưởng thành và giải phóng các phối tử chemokine (CXCL1/2/10/12), có liên quan đến việc tạo ra sắc tố và biểu hiện của MMP3 và 13 [101]. LC3 là một loại protein tham gia vào tất cả các giai đoạn của quá trình tự thực và các melanocyte từ lớp đáy trong tổn thương nám được phát hiện có biểu hiện thấp của các protein liên kết với microtube 1A/1B chuỗi nhẹ 3B (LC3B), cho thấy sự suy giảm trong quá trình tự thực [102].
Sự lão hóa nguyên bào sợi được ghi nhận rõ ở da lão hóa, đặc biệt là sau khi tiếp xúc với tia UV [103]. Lớp bì trong tổn thương nám nổi bật ở các nguyên bào sợi lão hóa, ít hình thoi hơn và tỷ lệ phân bào thấp hơn; hơn nữa, các tế bào này có tiết chất tiền viêm và thúc đẩy tạo melanin (ví dụ: SCF, HGF và NGFb) [16, 28]. Do đó, các chiến lược can thiệp vào kiểu bài tiết của chúng và loại bỏ các tế bào lão hóa có thể làm giảm tái phát nám và cải thiện sắc tố [104].
Cuối cùng, một nghiên cứu về protein trên da bị nám xác định được 29 loại protein khác nhau được điều hòa liên quan đến quá trình chuyển hóa năng lượng, hiện tượng vận chuyển tế bào, kiểm soát sự hình thành melanin, cầm máu, sửa chữa và phản ứng với stress oxy hóa [105].
Tất cả những thay đổi chức năng này của vùng da bị nám củng cố một kiểu hình tại chỗ không chỉ liên quan đến quá trình tăng sản xuất melanin mà còn thay đổi trong toàn bộ lớp biểu bì và lớp bì nông, như được thảo luận dưới đây.
THAY ĐỔI HÌNH THÁI
Lớp biểu bì trong nám biểu hiện những thay đổi về hình thái ngoài sự tăng melanin. Lớp sừng nén chặt hơn so với vùng da lân cận và lớp hạt bị teo, với các đường gờ phẳng và biểu bì mỏng đi. Nhân tế bào sừng lớp đáy có kích thước lớn hơn, mất phân cực, hình dạng không đều, tăng sắc tố và không đồng nhất về chất nhiễm sắc (Hình 2a) so với vùng da lân cận [1, 106]. Lăn kim thúc đẩy phục hồi sớm độ dày của biểu bì và tăng Ki67 ở những bệnh nhân bị nám da mặt [107].
Yếu tố hình thái quan trọng nhất trong nám là mật độ eumelanin biểu bì tăng lên ở tất cả các lớp, bao gồm cả lớp sừng (Hình 2b), trong đó có sự thoái hóa melanin nhiều hơn so với vùng da lân cận [108].
Melanosome chuyển giao qua lớp biểu bì ở nám lớn hơn, trưởng thành hơn và số lượng nhiều hơn so với những tế bào ở vùng da tiếp xúc với ánh sáng lân cận. Những thay đổi này không phụ thuộc vào kiểu da (Hình 3) [109]. Các công nghệ với mật độ năng lượng thấp (laser toning) nhắm mục tiêu phá hủy melanosome trong biểu bì với tổn thương nhiệt tối thiểu và đẩy nhanh kết quả lâm sàng của các phương pháp điều trị nám thông thường; tuy nhiên, chúng không nhắm mục tiêu vào những thay đổi bên dưới duy trì sắc tố do kích thích [110].
Mật độ melanin ở lớp bì nông thấp hơn khoảng 50–100 lần so với ở lớp biểu bì (Hình 2b). Hơn nữa, không có sự khác biệt về lượng melanin ở trung bì giữa da bị nám và vùng da tiếp xúc với ánh sáng lân cận, nhưng nó đậm hơn so với da được bảo vệ khỏi ánh sáng [1]. Melanin ở lớp bì nông tăng lên cùng với tổn thương do ánh sáng, và nó thường nổi bật hơn ở những người da sẫm màu hơn.
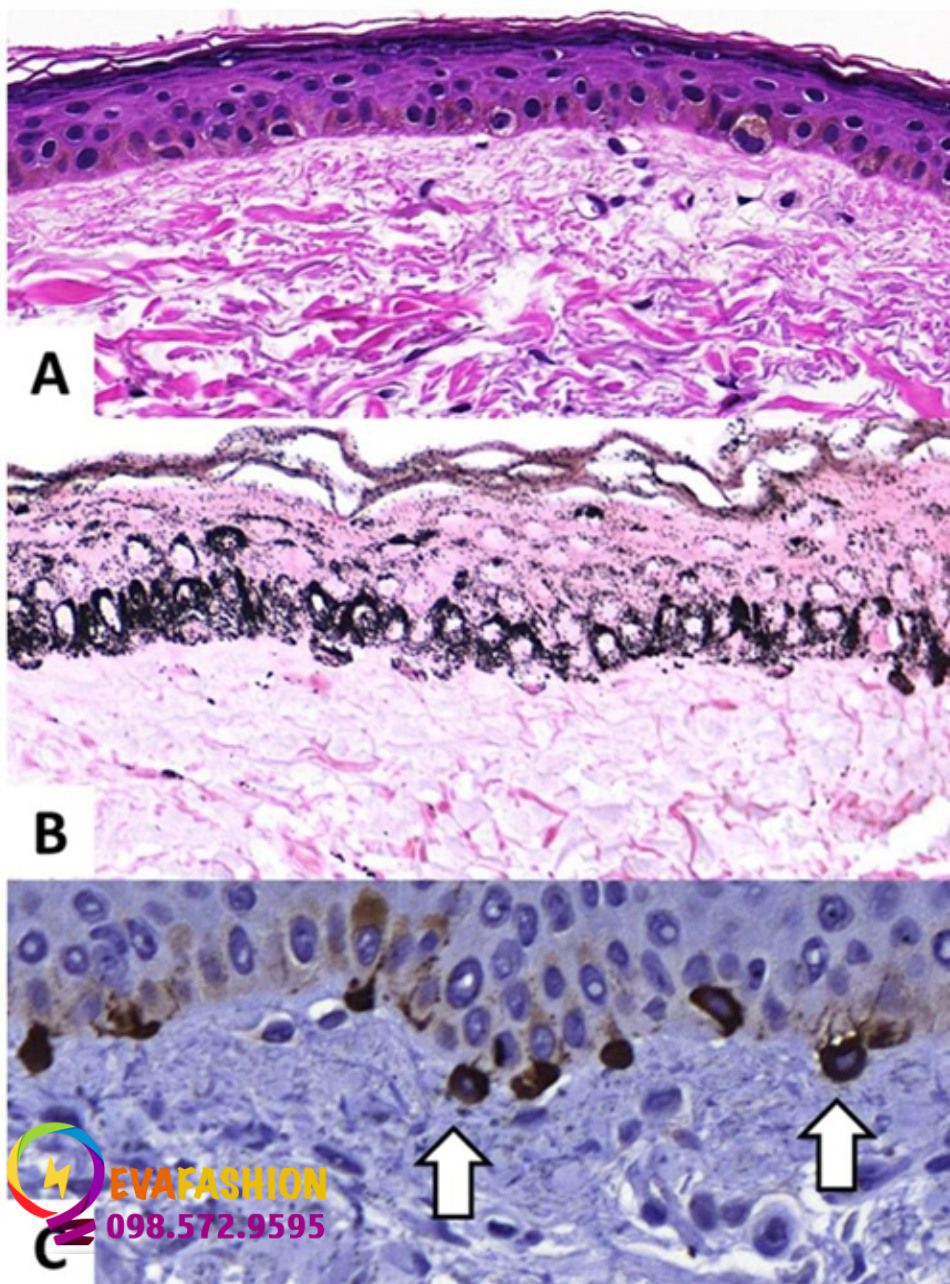
A. Lớp biểu bì teo với lớp sừng mỏng, giảm hạt và mất phân cực của nhân ở lớp đáy. Lớp bì nông cho thấy giảm đàn hồi do ánh sáng mặt trời và tổng thể các sợi collagen không có cấu trúc (hematoxylin và eosin). B. Sắc tố melanin dày đặc và đồng nhất với các melanosome thô ở tất cả các lớp biểu bì, bao gồm cả lớp sừng và các hạt melanin ngoại bào ở lớp bì nông. C. Lớp biểu bì teo với các melanocyte phì đại (màu nâu) với các đuôi gai nổi bật và melanocyte nhô vào lớp trung bì (tế bào hắc tố dạng quả lắc, mũi tên) và mất tiếp xúc với lớp đáy.
Vai trò của melanin trung bì trong nám liên quan đến biểu hiện sắc tố lâm sàng và vai trò của nó trong kháng trị vẫn còn là một vấn đề được thảo luận. Melanin trung bì không khác nhau giữa nám biểu bì và nám bì, như được đánh giá bằng đèn Wood, nhấn mạnh rằng sự khác biệt ghi nhận được trong phân loại lâm sàng này không được hỗ trợ bởi các phát hiện mô học [111, 112]. Trong một nghiên cứu trên 56 bệnh nhân bị nám, chỉ có 7 (12%) biểu hiện tăng melanin trung bì và melanophages so với những bệnh nhân khác [113]. Các loạt nghiên cứu khác không tìm thấy sự khác biệt về melanin trung bì giữa da bị nám và da quanh tổn thương [109, 114]. Tuy nhiên, một loạt nghiên cứu của Ấn Độ đã phát hiện ra rằng tình trạng mất kiểm soát sắc tố và melanophages ở lớp bì thường xảy ra ở vùng da bị nám hơn vùng da lân cận. Đáng chú ý, trong nghiên cứu đó, melanin trung bì có bằng chứng ở 77% số người tham gia và được phân loại là nám biểu bì, không có sự khác biệt giữa nám bì và hỗn hợp [115]. Hơn nữa, mặc dù làm sáng hiệu quả các tổn thương nám sau khi điều trị bằng thuốc kết hợp ba thành phần, lăn kim hoặc axit tranexamic, nhưng không có sự khác biệt về melanin trung bì so với trước khi điều trị [116].
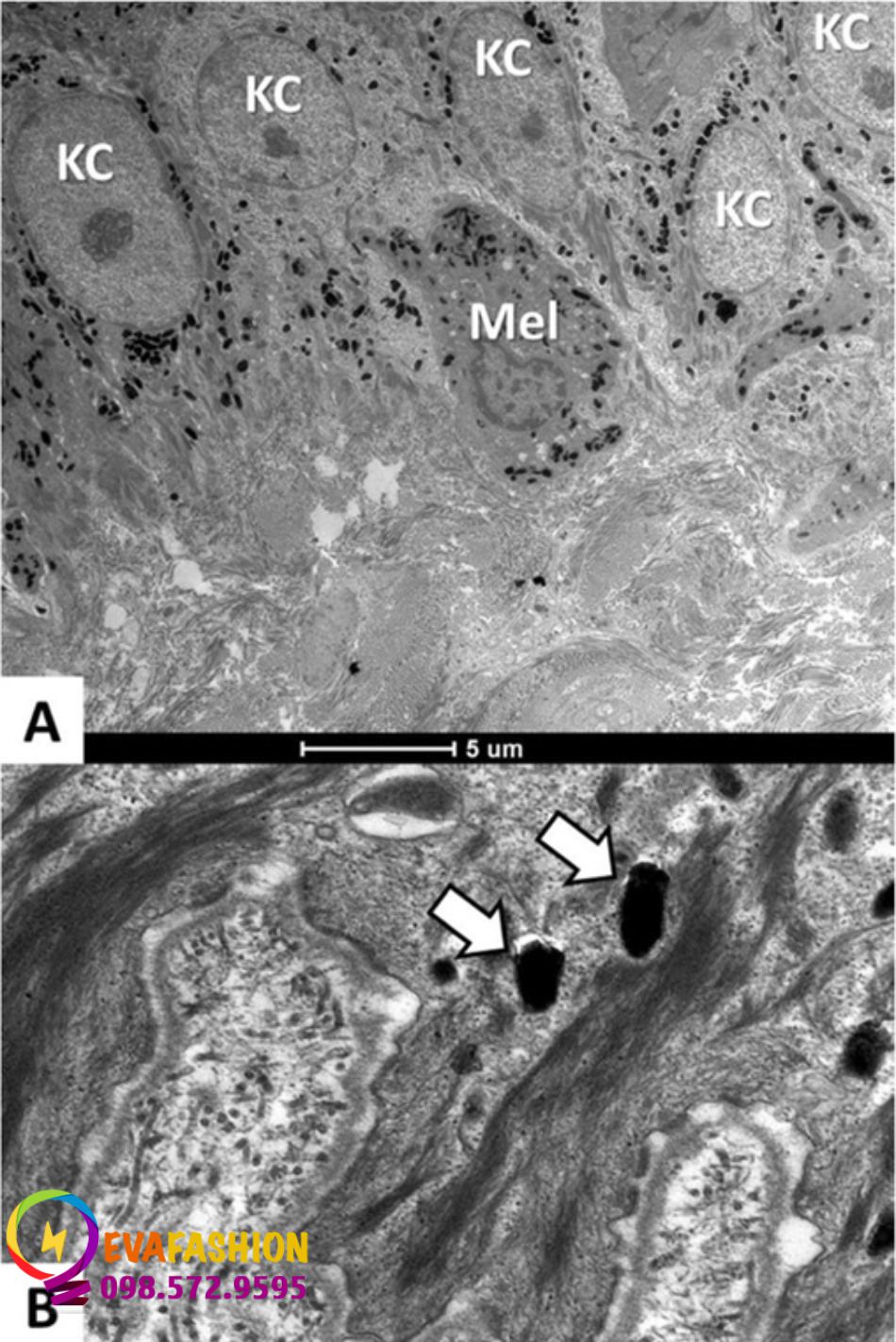
Sự phân bố dày đặc của các melanosome trưởng thành trong lớp biểu bì (KC, tế bào sừng; Mel, tế bào hắc tố). Các melanosome ngoại bào thưa thớt ở lớp bì nông. B. Melanosome trưởng thành và lớn (loại IV) trong tế bào chất của tế bào sừng từ lớp đáy (mũi tên trắng)
Các melanocyte tăng về thể tích và đuôi gai của chúng nổi bật hơn ở lớp đáy của da bị nám (Hình 2c) so với vùng da tiếp xúc với ánh sáng lân cận. Tuy nhiên, không có bằng chứng về sự gia tăng đáng kể về mật độ melanocyte, như thấy ở các đốm nâu do ánh sáng mặt trời [109, 113, 117].
Các melanocyte hình dạng con lắc nhô ra từ lớp đáy vào trong lớp bì (Hình 2c, 3a) [118]. Chúng thường gặp ở da bị nám hơn ở vùng da lân cận và có mối tương quan với độ nén của lớp sừng, số lượng tế bào mast và tổn thương đàn hồi do ánh nắng mặt trời [1]. Tuy nhiên, chúng không tương quan với các rối loạn khu vực màng đáy, cho thấy rằng sự hiện diện của các tế bào này là kết quả của việc tiếp xúc lâu dài với tia UV (đặc biệt là UVA1). Tuy nhiên, vì các melanocyte bình thường không tồn tại trong lớp bì và các melanocyte hình con lắc mất kết nối với lớp biểu bì, nên chúng không liên quan đến sắc tố biểu bì hoặc quá trình tạo melanin tích cực ở lớp bì [119]. Vì một số phương pháp điều trị nám hiệu quả (như axit tranexamic đường uống) làm giảm số lượng melanocyte hình con lắc, nên việc làm rõ vai trò của các tế bào này trong cơ chế bệnh sinh của nám có thể là chìa khóa để phát triển các chiến lược điều trị mới [116].
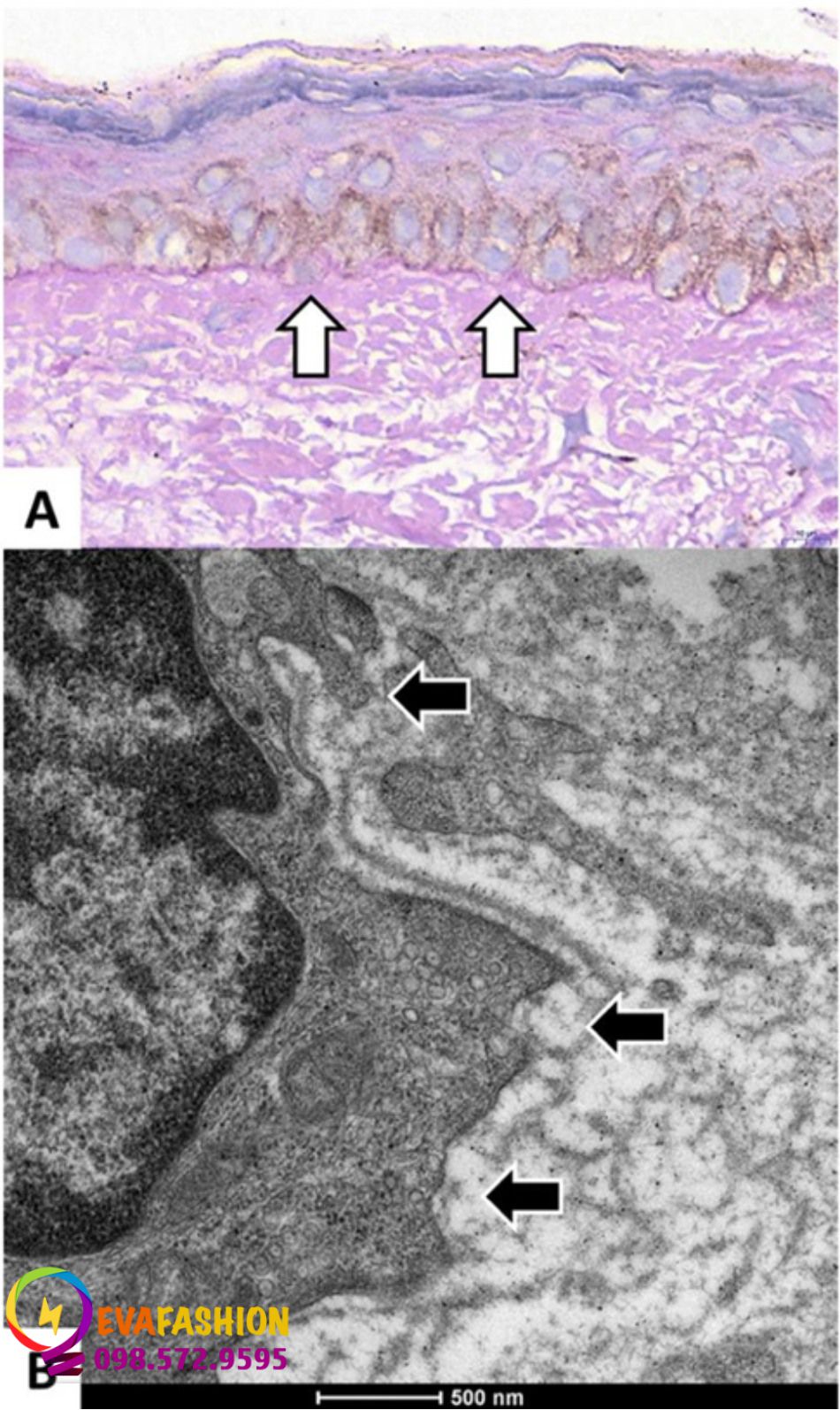
A. Có sự mỏng đi và một số điểm mất liên tục trong màng đáy (mũi tên trắng). B. Hình ảnh dưới kính hiển vi điện tử của điểm nối biểu bì- bì bên dưới một melanocyte cho thấy sự gián đoạn hoàn toàn của lớp lamina densa, tổn thương cấu trúc và mất các sợi neo trong lớp lamina lucida (mũi tên đen)
Sự gián đoạn và khoảng trống thường gặp hơn ở màng đáy da bị nám so với vùng da khỏe mạnh liền kề (Hình 4). Lớp lamina densa mỏng hơn và mất đi các sợi neo từ lớp lamina lucida [120]. Tổn thương cấu trúc đối với màng đáy tạo điều kiện thuận lợi cho việc vận chuyển các cytokine ở lớp bì đến lớp biểu bì. Điều này có thể được thúc đẩy bằng cách tăng hoạt động của MMP2 và MMP9, gây ra sự thoái hóa của collagen loại IV và VII [120]. Biểu hiện của tế bào sừng của CDH11 có liên quan đến tổn thương màng đáy trong nám [12]. Lăn kim thúc đẩy quá trình phục hồi sớm tổn thương màng đáy ở những bệnh nhân bị nám da mặt [107].
Có ý kiến cho rằng những thay đổi ở lớp bì nông là nguyên nhân duy trì và tái phát nám. Điều hòa cận tiết ở lớp bì đối với quá trình hình thành melanin bằng các cơ chế chưa được biết đầy đủ gây ra sự kích thích lâu dài đối với sắc tố biểu bì, đây là một quá trình do tia UV gây ra liên quan đến chu trình lão hóa oxy hóa tế bào (dưới dạng nguyên bào sợi lão hóa) liên quan đến phản hồi của các cytokine [96, 121].
Tổn thương đàn hồi do ánh sáng mặt trời (solar elastosis, SE) nổi bật hơn ở vùng da bị nám (Hình 5a) so với vùng da tiếp xúc với ánh sáng lân cận. Nó phần lớn là kết quả của việc kích hoạt metallicoproteinase ở lớp bì nông do kích hoạt UVR, MC và kiểu bài tiết của nguyên bào sợi lão hóa [1, 113, 118]. SE không được coi là một hiện tượng phụ của lão hóa da do ánh nắng mà là một điều kiện đặc trưng cho sự phát triển của nám. Mức độ nghiêm trọng của SE có tương quan với sự không đồng nhất của collagen sau khi bị phân mảnh, tế bào của lớp bì nông, sự gia tăng tế bào mast và mạch máu ở lớp bì, melanocyte hình con lắc, sự nén chặt của lớp sừng và tổn thương sợi elastin, cho thấy sự tổng hợp của các thành phần khác nhau trong cơ chế bệnh sinh của nám [1, 122].
Da bị nám biểu hiện tăng mật độ mạch máu (Hình 5b) với tăng biểu hiện của VEGF, là yếu tố có khả năng tạo mạch có liên quan. Sự tăng sinh nội mô cũng tương quan với cường độ hình thành sắc tố gây nám [22, 97]. Pycnogenol, axit tranexamic và laser mạch máu cải thiện nám da bằng cách giảm sự tăng sinh mạch máu [22, 123].
Tế bào mast quanh mạch máu tăng lên ở lớp bì nông của da bị nám (Hình 5c) so với vùng da tiếp xúc với ánh sáng lân cận, trong đó tế bào mast tăng lên so với vùng da sau tai [1]. Bệnh nhân bị nám được điều trị bằng axit tranexamic đường uống đã giảm số lượng tế bào mast ở lớp bì nông [124]. Hơn nữa, những phụ nữ bị nám được điều trị bằng ketotifen và famotidine đường uống đã cho thấy sự cải thiện về mặt lâm sàng và chỉ số màu vượt trội so với giả dược, củng cố vai trò của các tế bào này trong cơ chế bệnh sinh của nám [125].
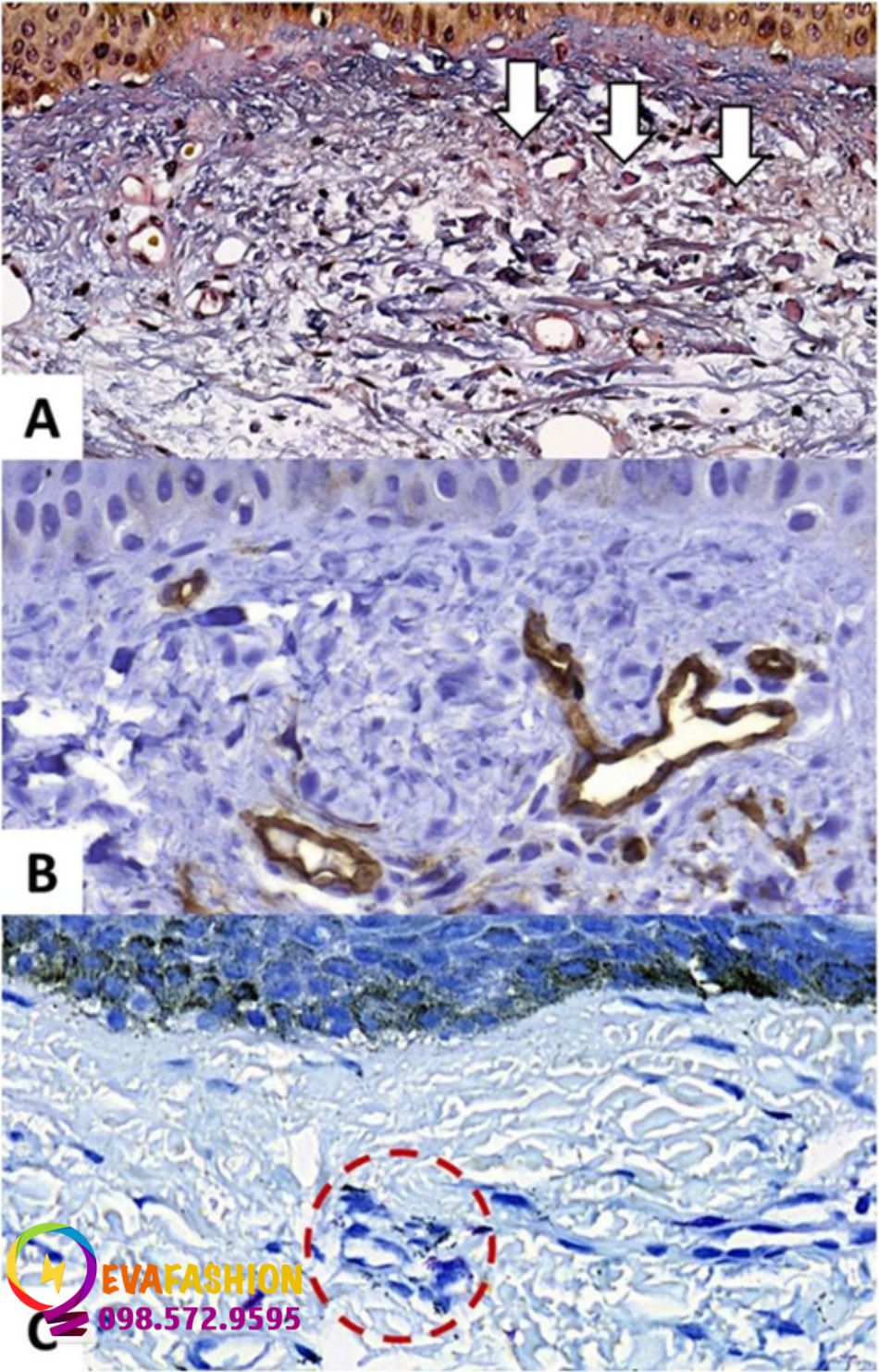
A. Hình ảnh mô học cho thấy sự phân mảnh sợi collagen ở lớp bì cùng với sự mất cấu trúc và sự đàn hồi (solar elastosis, mũi tên). B. Hình ảnh hóa mô miễn dịch của nám da mặt chứng minh sự tăng sinh nội mô lớp bì nông (cấu trúc màu nâu). C. Hình ảnh mô học chứng minh tế bào mast ở lớp bì nông, đặc biệt là ở vùng quanh mạch máu (vòng tròn nét đứt).
Tế bào mast không phổ biến ở da bình thường được bảo vệ khỏi ánh sáng, vì chúng là tế bào tác động trong các đáp ứng dị ứng và tham gia vào quá trình tái tạo và sửa chữa mô. Sự di cư của chúng đến lớp bì trong tổn thương nám được điều hòa bởi SCF, được tiết ra bởi các nguyên bào sợi lão hoá (Hình 6) [26]. Hoạt động của tế bào mast bị ảnh hưởng bởi các ảnh hưởng môi trường và tế bào mast thoái hóa do các kích thích, như tiếp xúc với nhiệt, áp suất và tia UV. Viêm và neurokinin cũng gây ra sự giải phóng nhiều chất trung gian có hoạt tính sinh học (như heparin, bradykinin, serotonin, thromboxane, prostaglandin và leukotrienes). Liên quan nhất là histamin, là thành phần chiếm ưu thế trong các hạt tế bào [29]. Histamine dường như đóng một vai trò trung tâm trong quá trình hình thành melanin; melanocyte của người được điều trị bằng histamine trải qua những thay đổi về hình thái và tăng hoạt động tyrosinase. Những tác dụng này bị ức chế hoàn toàn bởi chất đối kháng H2 chứ không phải bởi chất đối kháng H1 [126].
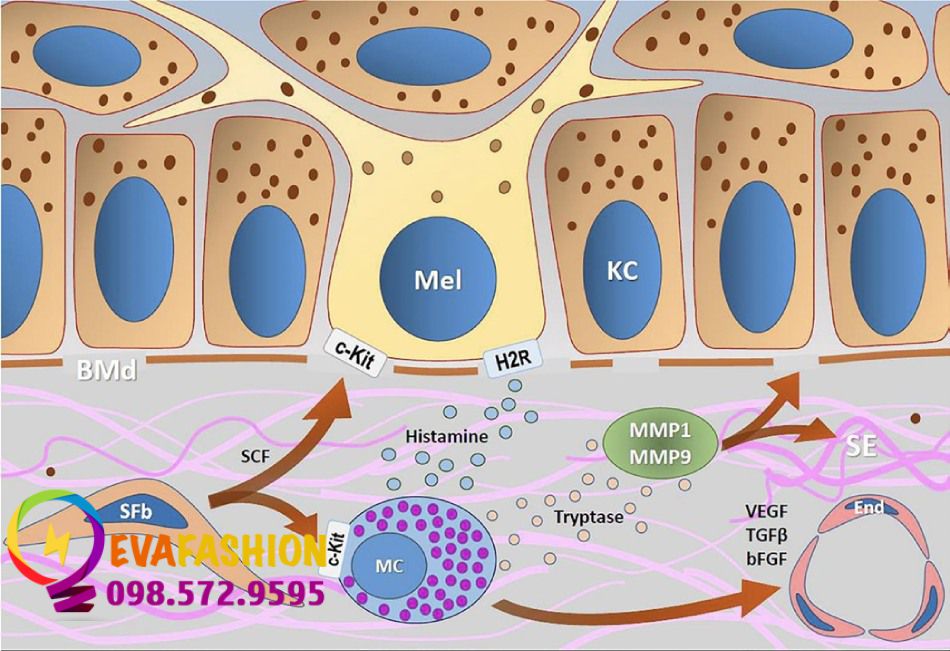
Histamine kích thích quá trình tạo melanin trực tiếp thông qua thụ thể H2 (H2Rs) trong melanocyte (Mels). SCF biểu hiện quá mức trong nám, ảnh hưởng đến sự sống sót, di cư và kích hoạt của tế bào mast; nó liên kết với thụ thể c-KIT, thúc đẩy sự hình thành melanin và chu trình tế bào Mel. Tryptase kích hoạt metallicoproteinase (MMP1 và MMP9), làm thoái hoá collagen loại I và IV, dẫn đến thoái hóa chất nền ngoại bào (solar elastosis; SE) và tổn thương màng đáy (BMd). Tế bào mast cũng gây ra sự tăng sinh nội mô (End) bằng cách tiết ra VEGF, bFGF và TGF-b.
Ngoài ra, tế bào mast giải phóng các enzyme có tác động mô tại chỗ. Quan trọng nhất là tryptase, góp phần kích hoạt MMP và thoái hóa collagen ở lớp bì nông. Những enzyme hoạt động này làm thoái hóa collagen loại IV và làm tổn thương màng đáy [106].
Tế bào mast có thể gây ra sự tăng sinh mạch máu bằng cách tiết ra các yếu tố tạo mạch, bao gồm VEGF, yếu tố tăng trưởng nguyên bào sợi-2 và yếu tố tăng trưởng biến đổi-b (TGF-b). Những phát hiện này cho thấy tế bào mast có liên quan đến lão hóa do tia UV gây ra do tiếp xúc kéo dài và thúc đẩy tổn thương đàn hồi, tổn thương màng đáy và tăng sinh mạch máu, tất cả đều là những đặc điểm nổi bật của da bị nám [106].
Vai trò của tế bào bã nhờn trong nám vẫn chưa được xác định. Các tuyến bã nhờn là một nguồn của VEGF, IL-1 và IL-6. Các tế bào tuyến bã nhờn trong ống nghiệm tiếp xúc với tia UVA gây ra sự sản xuất a-MSH, endothelin 1 (EDN1), b-FGF, SCF, và các cytokine và chất trung gian gây viêm. Hơn nữa, môi trường điều hòa tế bào bã nhờn làm tăng sắc tố trong melanocyte. Trong ống nghiệm, các melanocyte được nuôi cấy cùng với các tế bào bã nhờn có tỷ lệ tăng sinh và đuôi gai cao hơn, cho thấy rằng các tuyến bã nhờn có thể điều chỉnh sắc tố melanin [127, 128]. Mặc dù nám vùng giữa mặt thường gặp hơn, nhưng các vùng có mật độ bã nhờn cao như đầu mũi, ấn đường và cằm, không bị ảnh hưởng trong hầu hết các trường hợp.
Trên thực tế, tổn thương ở vùng màng đáy (BMZ), solar elatosis và tăng tế bào mast cũng được thấy ở da bị lão hóa do ánh sáng, và vì nám ảnh hưởng đến da bị lão hóa do ánh nắng, nên có ý kiến cho rằng nám là một rối loạn lão hóa do ánh sáng [18, 129]. Tuy nhiên, khi so sánh giữa da nám, da tiếp xúc với ánh sáng và da sau tai, mặc dù có sự liên tục giữa những phát hiện này tại các vị trí, sự thay đổi ở hàng rào bảo vệ da, melanocyte hình con lắc, sự phân mảnh collagen ở lớp bì nông và số lượng tế bào CD34 nhiều hơn trong nám nhưng không khác nhau giữa da tiếp xúc với ánh sáng và da sau tai, dẫn đến giả thuyết về nám là một kiểu hình cá nhân hoá xuất hiện từ da bị lão hóa [1].
Ngoài ra, các nghiên cứu sâu hơn về cơ chế bệnh sinh của nám nên sử dụng vùng da bị lão hoá ánh sáng liền kề, vì cấu trúc mô học, mật độ melanocyte, melanophage, tế bào mast, nang lông và các đo lường chức năng cho thấy sự khác biệt lớn khi so sánh da mặt và da ngoài mặt [130].
NGUYÊN NHÂN KHÁC
Nám da có liên quan đến các tác nhân khác, chẳng hạn như thuốc, phương pháp điều trị thẩm mỹ, viêm da tiếp xúc và các sự kiện gây stress.
Vai trò của thuốc và mỹ phẩm bôi tại chỗ đối với nám đã được báo cáo, nhưng giả thuyết này vẫn chưa được xác nhận. Trong một nghiên cứu bao gồm những bệnh nhân bị nám được thử nghiệm patch test, loạt mỹ phẩm và hương liệu tạo ra đáp ứng tích cực ở 43%, nhưng loạt kem chống nắng không tạo ra bất kỳ đáp ứng tích cực nào. Tần suất tích cực cao cho thấy mức độ nhạy cảm khi tiếp xúc với mỹ phẩm có thể là nguyên nhân gây ra nám [131]. Ở miền Bắc Ấn Độ, dầu mù tạt thường được sử dụng trên mặt như một chất làm mềm và trên da đầu để mọc tóc. Nó là một chất nhạy cảm ánh sáng được biết đến có thể hoạt động như một tác nhân gây nám da ở những người dễ mắc [57].
Các sự kiện gây stress cấp tính có liên quan đến sự phát triển hoặc làm trầm trọng thêm tình trạng nám da [132]. Đáng chú ý, các hormone liên quan đến stress, như propiomelanocortin, là chất tạo melanin thông qua kích hoạt MC1R, như xảy ra trong bệnh Addison, mặc dù sự sản xuất sinh lý của tuyến yên không ảnh hưởng đến sắc tố da. Khi so sánh với các đối chứng phù hợp, tỷ lệ phụ nữ bị nám da sử dụng thuốc chống trầm cảm và giải lo âu cao hơn, đồng thời điểm số lo lắng và trầm cảm của họ cũng cao hơn [5]. Những thay đổi tâm lý thần kinh khác ở bệnh nhân nám da là sự tự tin thấp, chất lượng giấc ngủ kém và độ chính xác cao hơn trong việc nhận biết biểu cảm sợ hãi trên khuôn mặt, cho thấy quá trình xử lý cảm xúc khác biệt của não bộ [132, 133].
Nám da đã được báo cáo sau khi lột da bằng hoá chất, IPL và các phương pháp điều trị xâm lấn, tất cả đều được biết là tác nhân kích thích tăng sắc tố sau viêm. Sự liên quan của hai tình trạng này đã được ghi nhận rõ và tình trạng tăng sắc tố sau viêm thường gặp hơn 2,8 lần ở những bệnh nhân bị nám da. Nám da cũng liên quan đến đốm nâu và nevi, cho thấy khuynh hướng tăng sinh melanocyte ở những bệnh nhân này.
Các xã hội đô thị và công nghiệp hóa có liên quan đến việc tiếp xúc nhiều hơn với các chất gây ô nhiễm không khí, dẫn đến gánh nặng sức khỏe đáng kể bao gồm các rối loạn da liễu [136]. Chất trung gian chính của các tác động ô nhiễm không khí trên da là thụ thể aryl hydrocarbon (AhR), được kích hoạt bởi các hydrocarbon thơm có nhiều trong khói xe. AhR tham gia vào chu kỳ tế bào và quá trình hình thành melanin thông qua quá trình tái điều hòa tyrosinase trong các melanocyte. Phơi nhiễm tia UV tạo ra 6-formylindolo[3,2-b] carbazole, là phối tử có ái lực cao và là chất kích hoạt nội sinh của yếu tố phiên mã AhR [137, 138]. Trên thực tế, tỷ lệ nám da dường như đang gia tăng trên toàn thế giới, đặc biệt là ở các quốc gia có chỉ số ô nhiễm không khí cao hơn.
Sự hình thành melanin có thể được điều chỉnh bởi các yếu tố biểu sinh, như miRNA, quá trình methyl hóa DNA và điều khiển sau phiên mã. Biểu hiện thấp hơn của miR-675 và miR-1299 được chứng minh ở vùng da bị nám so với vùng lân cận.
Cuối cùng, chiếu xạ mắt bằng tia UV gây ra sự giải phóng trung tâm propiomelanocortin bởi tuyến tùng [144]. Mặc dù tiềm năng sắc tố của con đường ngoài da này chưa được chứng minh ở người, nhưng nó đã có bằng chứng rõ ở chuột, trong đó chiếu tia UVB của mắt kích thích melanocyte biểu bì và tạo melanin.
Tất cả những yếu tố đóng vai trò hình thành sắc tố da này cần được nghiên cứu một cách có hệ thống trong nám da, vì sự tái phát của bệnh sau khi điều trị và chống nắng đầy đủ có thể được thúc đẩy bởi một số yếu tố khác.
KẾT LUẬN
Mặc dù tỷ lệ phổ biến cao và nhu cầu chăm sóc da liễu, các cơ chế dẫn đến sắc tố kéo dài trong nám vẫn chưa được hiểu rõ hoàn toàn. Ngoài tính nhạy cảm di truyền của từng cá nhân, một số thay đổi kiểu hình đã được xác định ở lớp biểu bì và lớp bì nông trong nám da, đặc biệt liên quan đến sự thiếu hụt khả năng tự thực bào của melanocyte và sự lão hóa của nguyên bào sợi. Hơn nữa, vai trò của các yếu tố nội tiết và stress oxy hóa là những vấn đề cần nghiên cứu trong tương lai về các hoạt động toàn thân và tại chỗ của chúng (trong môi trường vi mô da), cũng như cách bức xạ của các bước sóng khác nhau can thiệp vào quá trình tạo melanin trong nám.
Đáp ứng sắc tố trong nám có liên quan đến sự tương tác của nhiều yếu tố. Khi khoa học da liễu hiểu rõ hơn về quy luật của quá trình hình thành melanin bình thường, lão hóa do ánh nắng và cơ chế bệnh sinh của nám, các con đường mới sẽ xuất hiện như những mục tiêu khả thi cho các chiến lược điều trị và phòng ngừa hiệu quả.
TÀI LIỆU THAM KHẢO
- Esposito ACC, Brianezi G, de Souza NP, Miot LDB, Miot HA. Exploratory study of epidermis, basement membrane zone, upper dermis alterations and Wnt pathway activation in melasma compared to adja- cent and retroauricular Ann Dermatol. 2020;32(2):101–8.
- Tamega Ade A, Miot LD, Bonfietti C, Gige TC, Marques ME, Miot HA. Clinical patterns and epi- demiological characteristics of facial melasma in Brazilian women. J Eur Acad Dermatol Venereol. 2013;27(2):151–6.
- Ishiy PS, Silva LR, Penha MA, Handel AC, Miot Skin diseases reported by workers from UNESP campus at Rubiao Jr, Botucatu-SP (Brazil). An Bras Dermatol. 2014;89(3):529–31.
- Ortonne JP, Arellano I, Berneburg M, Cestari T, Chan H, Grimes P, et al. A global survey of the role of ultraviolet radiation and hormonal influences in the development of melasma. J Eur Acad Dermatol Venereol. 2009;23(11):1254–62.
- Handel AC, Lima PB, Tonolli VM, Miot LD, Miot HA. Risk factors for facial melasma in women: a case-control study. Br J Dermatol. 2014;171(3): 588–94.
- McEvoy B, Beleza S, Shriver MD. The genetic architecture of normal variation in human pigmentation: an evolutionary perspective and model. Hum Mol Genet. 2006;15 Spec No 2: R176–81.
- Holmo NF, Ramos GB, Salomao H, Werneck RI, Mira MT, Miot LDB, et al. Complex segregation analysis of facial melasma in Brazil: evidence for a genetic susceptibility with a dominant pattern of Arch Dermatol Res. 2018;310(10): 827–31.
- D’Elia MP, Brandao MC, de Andrade Ramos BR, da Silva MG, Miot LD, Dos Santos SE, et al. African ancestry is associated with facial melasma in women: a cross-sectional BMC Med Genet. 2017;18(1):17.
- Kang HY, Suzuki I, Lee DJ, Ha J, Reiniche P, Aubert J, et al. Transcriptional profiling shows altered expression of
- Wnt pathway- and lipid metabolism- related genes as well as melanogenesis-related genes in melasma. J Invest Dermatol. 2011;131(8): 1692–700.
- Chung BY, Noh TK, Yang SH, Kim IH, Lee MW, Yoon TJ, et Gene expression profiling in mel- asma in Korean women. Dermatology. 2014;229(4): 333–42.
- Kim NH, Lee CH, Lee AY. H19 RNA downregulation stimulated melanogenesis in melasma. Pigment Cell Melanoma Res. 2010;23(1):84–92.
- Kim NH, Choi SH, Lee TR, Lee CH, Lee Cad- herin 11 involved in basement membrane damage and dermal changes in melasma. Acta Derm Venereol. 2016;96(5):635–40.
- Kim NH, Cheong KA, Lee TR, Lee AY. PDZK1 upregulation in estrogen-related hyperpigmenta- tion in melasma. J Invest Dermatol. 2012;132(11): 2622–31.
- Videira IF, Moura DF, Magina S. Mechanisms regu- lating melanogenesis. An Bras 2013;88(1):76– 83.
- Suryaningsih BE, Sadewa AH, Wirohadidjojo YW, Soebono Association between heterozygote Val92Met MC1R gene polymorphisms with inci- dence of melasma: a study of Javanese women population in Yogyakarta. Clin Cosmet Investig Dermatol. 2019;12:489–95.
- Esposito ACC, Brianezi G, Miot LDB, Miot HA. Morphology, growth rate and gene expression of fibroblasts in facial melasma. An Bras Dermatol. 2022;97(5):(ahead of print).
- Sklar LR, Almutawa F, Lim HW, Hamzavi I. Effects of ultraviolet radiation, visible light, and infrared radiation on erythema and pigmentation: a review. Photochem Photobiol Sci. 2013;12(1):54–64.
- Passeron T, Picardo M. Melasma, a photoaging dis- order. Pigment Cell Melanoma Res. 2018;31(4): 461–5.
- Yardman-Frank JM, Fisher DE. Skin pigmentation and its control: from ultraviolet radiation to stem cells. Exp Dermatol. 2021;30(4):560–71.
- Singh SK, Kurfurst R, Nizard C, Schnebert S, Perrier E, Tobin Melanin transfer in human skin cells is mediated by filopodia—a model for homotypic and heterotypic lysosome-related organelle transfer. Faseb J. 2010;24(10):3756–69.
- Iriyama S, Ono T, Aoki H, Amano S. Hyperpig- mentation in human solar lentigo is promoted by heparanase-induced loss of heparan sulfate chains at the dermal-epidermal junction. J Dermatol Sci. 2011;64(3):223–8.
- Kim EH, Kim YC, Lee ES, Kang HY. The vascular characteristics of melasma. J Dermatol Sci. 2007;46(2):111–6.
- Polefka TG, Meyer TA, Agin PP, Bianchini RJ. Effects of solar radiation on the skin. J Cosmet Dermatol. 2012;11(2):134–43.
- Svobodova AR, Galandakova A, Sianska J, Dolezal D, Ulrichova J, Vostalova J. Acute exposure to solar simulated ultraviolet radiation affects oxidative stress- related biomarkers in skin, liver and blood of hairless Biol Pharm Bull. 2011;34(4):471–9.
- Romero-Graillet C, Aberdam E, Clement M, Ortonne JP, Ballotti R. Nitric oxide produced by ultraviolet-irradiated keratinocytes stimulates melanogenesis. J Clin Invest. 1997;99(4):635–42.
- Kang HY, Hwang JS, Lee JY, Ahn JH, Kim JY, Lee ES, et al. The dermal stem cell factor and c-kit are overexpressed in melasma. Br J Dermatol. 2006;154(6):1094–9.
- Kim M, Han JH, Kim JH, Park TJ, Kang HY. Secreted frizzled-related protein 2 (sFRP2) functions as a melanogenic stimulator; the role of sFRP2 in UV- induced hyperpigmentary disorders. J Invest Der- matol. 2016;136(1):236–44.
- Kim M, Kim SM, Kwon S, Park TJ, Kang HY. Senes- cent fibroblasts in melasma pathophysiology. Exp Dermatol. 2019;28(6):719–22.
- Siiskonen H, Smorodchenko A, Krause K, Maurer M. Ultraviolet radiation and skin mast cells: Effects, mechanisms and relevance for skin diseases. Exp Dermatol. 2018;27(1):3–8.
- Wang Z, Lu F, Li X, Guo Y, Li J, He Chinese women with melasma exhibit a low minimal ery- thema dose to both UVA and UVB. Photodermatol Photoimmunol Photomed. 2022;38(1):38–43.
- Cohen L, Brodsky MA, Zubair R, Kohli I, Hamzavi IH, Sadeghpour M. Cutaneous interaction with visible light: what do we know. J Am Acad Derma- 2020:(ahead of print).
- Esposito ACC, de Souza NP, Miot LDB, Miot HA. Expression of OPN3 in fibroblasts, melanocytes, and keratinocytes of skin with facial melasma in com- parison with unaffected adjacent skin. An Bras 2021;96(3):367–9.
- Castanedo-Cazares JP, Hernandez-Blanco D, Carlos- Ortega B, Fuentes-Ahumada C, Torres-Alvarez B. Near- visible light and UV photoprotection in the treatment of melasma: a double-blind randomized trial. Photodermatol Photoimmunol Photomed. 2014;30(1):35–42.
- Kohli I, Chaowattanapanit S, Mohammad TF, Nicholson CL, Fatima S, Jacobsen G, et al. Syner- gistic effects of long-wavelength ultraviolet al and visible light on pigmentation and erythema. Br J Dermatol. 2018;178(5):1173–80.
- Alcantara GP, Esposito ACC, Olivatti TOF, Yoshida MM, Miot HA. Evaluation of ex vivo melanogenic response to UVB, UVA, and visible light in facial melasma and unaffected adjacent skin. An Bras Dermatol. 2020;95(6):684–90.
- Duarte IA, Hafner Mde F, Malvestiti AA. Ultraviolet radiation emitted by lamps, TVs, tablets and com- puters: are there risks for the population? An Bras 2015;90(4):595–7.
- Duteil L, Queille-Roussel C, Lacour JP, Montaudie H, Passeron T. Short-term exposure to blue light emitted by electronic devices does not worsen melasma. J Am Acad Dermatol. 2020;83(3):913–4.
- Schalka S, Steiner D, Ravelli FN, Steiner T, Terena AC, Marcon CR, et al. Brazilian consensus on pho- toprotection. An Bras Dermatol. 2014;89(6 Suppl 1): 1–74.
- Baltazar D, Brockman R, Simpson Kotatsu-in- duced erythema ab igne. An Bras Dermatol. 2019;94(2):253–4.
- Sarkar R, Jagadeesan S, Basavapura Madegowda S, Verma S, Hassan I, Bhat Y, et al. Clinical and epi- demiologic features of melasma: a multicentric cross- sectional study from India. Int J Dermatol. 2019;58(11):1305–10.
- Nii D, Esposito AC, Peres G, Schmitt JV, Miot Tinted sunscreens lead to a smaller amount of the product applied on the face. Int J Dermatol. 2020;59(12):e438–9.
- Resnik SS. Melasma and other skin manifestations or oral contraceptives. Trans N Engl Obstet Gynecol Soc. 1967;21:101–7.
- Moin A, Jabery Z, Fallah Prevalence and aware- ness of melasma during pregnancy. Int J Dermatol. 2006;45(3):285–8.
- Guinot C, Cheffai S, Latreille J, Dhaoui MA, Youssef S, Jaber K, et al. Aggravating factors for melasma: a prospective study in 197 Tunisian patients. J Eur Acad Dermatol Venereol. 2010;24(9):1060–9.
- Hassan I, Kaur I, Sialy R, Dash RJ. Hormonal milieu in the maintenance of melasma in fertile J Dermatol. 1998;25(8):510–2.
- Mahmood K, Nadeem M, Aman S, Hameed A, Kazmi AH. Role of estrogen, progesterone and pro- lactin in the etiopathogenesis of melasma in J Pak Assoc Derma. 2011;21(4):241–7.
- Gopichandani K, Arora P, Garga U, Bhardwaj M, Sharma N, Gautam Hormonal profile of mel- asma in Indian females. Pigment International. 2015;2(2):85.
- Perez M, Sanchez JL, Aguilo Endocrinologic pro- file of patients with idiopathic melasma. J Invest Dermatol. 1983;81(6):543–5.
- Martin AG, Leal-Khouri S. Physiologic skin changes associated with pregnancy. Int J Dermatol. 1992;31(6):375–8.
- Snyder A, Schiechert RA, Zaiac MN. Melasma asso- ciated with topical estrogen cream. J Clin Aesthet Dermatol. 2017;10(2):57–8.
- Johnston GA, Sviland L, McLelland J. Melasma of the arms associated with hormone replacement therapy. Br J Dermatol. 1998;139(5):932.
- Ritter CG, Fiss DV, Borges da Costa JA, de Carvalho RR, Bauermann G, Cestari TF. Extra-facial melasma: clinical, histopathological, and immunohisto- chemical case-control study. J Eur Acad Dermatol 2013;27(9):1088–94.
- [Chloasma in a man with total hypogo- nadism]. Bull Soc Fr Dermatol Syphiligr. 1957;64(5): 777–8.
- Burkhart C. Chloasma in a man due to oral hormone replacement. Skinmed. 2006;5(1):46–7.
- Famenini S, Gharavi NM, Beynet DP. Finasteride associated melasma in a Caucasian male. J Drugs Dermatol. 2014;13(4):484–6.
- Sialy R, Hassan I, Kaur I, Dash RJ. Melasma in men: a hormonal profile. J Dermatol. 2000;27(1):64–5.
- Handa S, De D, Khullar G, Radotra BD, Sachdeva N. The clinicoaetiological, hormonal and histopatho- logical characteristics of melasma in men. Clin Exp 2018;43(1):36–41.
- Thornton MJ. The biological actions of estrogens on skin. Exp Dermatol. 2002;11(6):487–502.
- Stevenson S, Thornton J. Effect of estrogens on skin aging and the potential role of Clin Interv Aging. 2007;2(3):283–97.
- Surazynski A, Jarzabek K, Haczynski J, Laudanski P, Palka J, Wolczynski S. Differential effects of estra- diol and raloxifene on collagen biosynthesis in cultured human skin fibroblasts. Int J Mol Med. 2003;12(5):803–9.
- Chaudhary SC, Singh T, Talwelkar SS, Srivastava RK, Arumugam A, Weng Z, et al. Erb-041, an estrogen receptor-beta agonist, inhibits skin photocarcino- genesis in SKH-1 hairless mice by downregulating the WNT signaling pathway. Cancer Prev Res (Phila). 2014;7(2):186–98.
- Chen N, Hu Y, Li WH, Eisinger M, Seiberg M, Lin The role of keratinocyte growth factor in melanogenesis: a possible mechanism for the initi- ation of solar lentigines. Exp Dermatol. 2010;19(10):865–72.
- Hosokawa M, Ishii M, Inoue K, Yao CS, Takeda T. Estrogen induces different responses in dermal and lung fibroblasts: special reference to Con- nect Tissue Res. 1981;9(2):115–20.
- Tamega Ade A, Miot HA, Moco NP, Silva MG, Marques ME, Miot LD. Gene and protein expression of oestrogen- beta and progesterone receptors in facial melasma and adjacent healthy skin in women. Int J Cosmet Sci. 2015;37(2):222–8.
- Im S, Lee ES, Kim W, On W, Kim J, Lee M, et Donor specific response of estrogen and proges- terone on cultured human melanocytes. J Korean Med Sci. 2002;17(1):58–64.
- Wiedemann C, Nagele U, Schramm G, Berking C. Inhibitory effects of progestogens on the estrogen stimulation of melanocytes in vitro. Contraception. 2009;80(3):292–8.
- Lutfi RJ, Fridmanis M, Misiunas AL, Pafume O, Gonzalez EA, Villemur JA, et al. Association of melasma with thyroid autoimmunity and other thyroidal abnormalities and their relationship to the origin of the melasma. J Clin Endocrinol Metab. 1985;61(1):28–31.
- Ameneh Y, Banafsheh H. Association of melasma with thyroid autoimmunity: a case-control study. Iran J Dermatol. 2010;13(2):51–3.
- Sacre RC, Fernandes NC, Vaisman M, Tendrich M. Melasma idiopa ́tico: avaliac ̧a ̈o das func ̧o ̈es tireoidi- ana, prolactı ́nica e gonodal An Bras Der- matol. 1996:195–8.
- Cakmak SK, Ozcan N, Kilic A, Koparal S, Artuz F, Cakmak A, et al. Etiopathogenetic factors, thyroid functions and thyroid autoimmunity in melasma patients. Postepy Dermatol Alergol. 2015;32(5): 327–30.
- Edalat Khah H, Mirza NM. Relationship between melasma, ovarian cysts and androgenic hormones: a case- control study. Iran J Dermatol. 2003;6(2): 14–9.
- Esposito ACC, Cassiano DP, Bagatin E, Miot HA. Regarding the alterations in oxidative stress status induced by melasma treatments. Arch Dermatol Res. 2021;313(8):705–6.
- Arjinpathana N, Asawanonda P. Glutathione as an oral whitening agent: a randomized, double-blind, placebo- controlled J Dermatolog Treat. 2012;23(2):97–102.
- Wiraguna A, Hari ED, Praharsini Correlation between glutathione plasma with degree severity of melasma in balinese women. Clin Cosmet Investig Dermatol. 2020;13:455–9.
- Seckin HY, Kalkan G, Bas Y, Akbas A, Onder Y, Ozyurt H, et al. Oxidative stress status in patients with melasma. Cutan Ocul Toxicol. 2014;33(3): 212–7.
- Choubey V, Sarkar R, Garg V, Kaushik S, Ghunawat S, Sonthalia S. Role of oxidative stress in melasma: a prospective study on serum and blood markers of oxidative stress in melasma patients. Int J Dermatol. 2017;56(9):939–43.
- Jo HY, Kim CK, Suh IB, Ryu SW, Ha KS, Kwon YG, et al. Co-localization of inducible nitric oxide syn- thase and phosphorylated Akt in the lesional skins of patients with melasma. J Dermatol. 2009;36(1): 10–6.
- Samaka RM, Bakry OA, Shoeib MA, Zaaza MM. Expression of iNOS and NF-kappaB in melasma: an immunohistochemical study. Anal Quant Cyto- pathol Histpathol. 2014;36(5):245–57.
- Snell RS, Bischitz PG. The effect of large doses of estrogen and estrogen and progesterone on melanin pigmentation. J Invest Dermatol. 1960;35:73–82.
- Sarkar R, Devadasan S, Choubey V, Goswami B. Melatonin and oxidative stress in melasma—an unexplored territory; a prospective study. Int J Dermatol. 2020;59(5):572–5.
- Hamadi SA, Mahammed MM, Aljaf AN, Ali The role of topical and oral melatonin in management of melasma patients. J Assoc Arab Univ Bas Appl Sc. 2010;8:30–42.
- Sampaio Xerfan EM, Andersen ML, Tomimori J, Tufik S, da Silva Melasma and the possible interaction with sleep quality. J Clin Aesthet Der- matol. 2020;13(11):12.
- Esposito ACC, Brianezi G, de Souza NP, Miot LDB, Marques MEA, Miot HA. Exploring pathways for sustained melanogenesis in facial melasma: an immunofluorescence study. Int J Cosmet Sci. 2018;40(4):420–4.
- Denat L, Kadekaro AL, Marrot L, Leachman SA, Abdel- Malek ZA. Melanocytes as instigators and victims of oxidative stress. J Invest Dermatol. 2014;134(6):1512–8.
- Babbush KM, Babbush RA, Khachemoune A. Treat- ment of melasma: a review of less commonly used antioxidants. Int J Dermatol. 2021;60(2):166–73.
- Lee DJ, Lee J, Ha J, Park KC, Ortonne JP, Kang HY. Defective barrier function in melasma skin. J Eur Acad Dermatol Venereol. 2012;26(12):1533–7.
- Weigmann HJ, Ulrich J, Schanzer S, Jacobi U, Schaefer H, Sterry W, et al. Comparison of transepidermal water loss and spectroscopic absor- bance to quantify changes of the stratum corneum after tape stripping. Skin Pharmacol Physiol. 2005;18(4):180–5.
- Rawlings Ethnic skin types: are there differences in skin structure and function? Int J Cosmet Sci. 2006;28(2):79–93.
- Xu J, Lu H, Luo H, Hu Y, Chen Y, Xie B, et al. Tape stripping and lipidomics reveal skin surface lipid abnormity in female melasma. Pigment Cell Mela- noma Res. 2021;34(6):1105–11.
- Pillaiyar T, Manickam M, Jung SH. Recent devel- opment of signaling pathways inhibitors of Cell Signal. 2017;40:99–115.
- Lima PB, Dias JAF, Cassiano DP, Esposito ACC, Miot LDB, Bagatin E, et al. Efficacy and safety of topical isobutylamido thiazolyl resorcinol (Thiamidol) vs. 4% hydroquinone cream for facial melasma: an evaluator- blinded, randomized controlled J Eur Acad Dermatol Venereol. 2021;35(9):1881–7.
- Byun JW, Park IS, Choi GS, Shin J. Role of fibroblast- derived factors in the pathogenesis of melasma. Clin Exp Dermatol. 2016;41(6):601–9.
- Hasegawa K, Fujiwara R, Sato K, Shin J, Kim SJ, Kim M, et al. Possible involvement of keratinocyte growth factor in the persistence of hyperpigmenta- tion in both human facial solar lentigines and Ann Dermatol. 2015;27(5):626–9.
- Yamada T, Hasegawa S, Inoue Y, Date Y, Yamamoto N, Mizutani H, et al. Wnt/beta-catenin and kit signaling sequentially regulate melanocyte stem cell differentiation in UVB-induced epidermal pigmentation. J Invest Dermatol. 2013;133(12):2753–62.
- Dijksterhuis JP, Petersen J, Schulte G. WNT/Frizzled signalling: receptor-ligand selectivity with focus on FZD- G protein signalling and its physiological rel- evance: IUPHAR Review 3. Br J Pharmacol. 2014;171(5):1195–
- Terazawa S, Imokawa Signaling cascades acti- vated by UVB in human melanocytes lead to the increased expression of melanocyte receptors, endothelin B receptor and c-KIT. Photochem Pho- tobiol. 2018;94(3):421–31.
- Regazzetti C, De Donatis GM, Ghorbel HH, Cardot- Leccia N, Ambrosetti D, Bahadoran P, et al. Endothelial cells promote pigmentation through endothelin receptor B activation. J Invest Dermatol. 2015;135(12):3096–104.
- Kim JY, Shin JY, Kim MR, Hann SK, Oh SH. siRNA- mediated knock-down of COX-2 in melanocytes suppresses melanogenesis. Exp Dermatol. 2012;21(6):420–5.
- Murase D, Kusaka-Kikushima A, Hachiya A, Ful- lenkamp R, Stepp A, Imai A, et al. Autophagy declines with premature skin aging resulting in dynamic alterations in skin pigmentation and epi- dermal differentiation. Int J Mol Sci. 2020;21(16):
- Kim JY, Kim J, Ahn Y, Lee EJ, Hwang S, Almurayshid A, et al. Autophagy induction can regulate skin pigmentation by causing melanosome degradation in keratinocytes and melanocytes. Pigment Cell Melanoma Res. 2020;33(3):403–15.
- Ni C, Narzt MS, Nagelreiter IM, Zhang CF, Larue L, Rossiter H, et Autophagy deficient melanocytes display a senescence associated secretory phenotype that includes oxidized lipid mediators. Int J Bio- chem Cell Biol. 2016;81(Pt B):375–82.
- Esposito ACC, de Souza NP, Miot LDB, Miot HA. Deficit in autophagy: A possible mechanism involved in melanocyte hyperfunction in melasma. Indian J Dermatol Venereol Leprol. 2021:1–3.
- Shin J, Kim JH, Kim Repeated exposure of human fibroblasts to UVR induces secretion of stem cell factor and senescence. J Eur Acad Dermatol Venereol. 2012;26(12):1577–80.
- Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirk- land JL. Cellular senescence and the senescent secretory phenotype: therapeutic opportunities. J Clin Invest. 2013;123(3):966–72.
- Schaefer L, Pontes LG, Cavassan NRV, Santos LD, Miot HA. Proteomic study of facial melasma. An Bras Dermatol. 2022;97(5):(ahead of print).
- Kwon SH, Hwang YJ, Lee SK, Park KC. Heteroge- neous pathology of melasma and its clinical impli- Int J Mol Sci. 2016;17(6):824.
- Cassiano DP, Esposito ACC, Hassun KM, Lima EVA, Bagatin E, Miot HA. Early clinical and histological changes induced by microneedling in facial mel- asma: A pilot study. Indian J Dermatol Venereol 2019;85(6):638–41.
- Moncada B, Sahagun-Sanchez LK, Torres-Alvarez B, Castanedo-Cazares JP, Martinez-Ramirez JD, Gon- zalez FJ. Molecular structure and concentration of melanin in the stratum corneum of patients with Photodermatol Photoimmunol Pho- tomed. 2009;25(3):159–60.
- Miot LD, Miot HA, Polettini J, Silva MG, Marques Morphologic changes and the expression of alpha- melanocyte stimulating hormone and mela- nocortin-1 receptor in melasma lesions: a compar- ative study. Am J Dermatopathol. 2010;32(7): 676–82.
- Micek I, Pawlaczyk M, Kroma A, Seraszek-Jaros A, Urbanska M, Gornowicz-Porowska J. Treatment of melasma with a low-fluence 1064 nm Q-switched Nd:YAG laser: Laser toning in Caucasian women. Lasers Surg Med. 2022;54(3):366–73.
- Tamler C, Fonseca R, Pereira F, Barcaui C. Classifi- cation of melasma by dermoscopy: comparative study with Wood’s lamp. Surg Cosm Dermatol. 2009;1(3):115–
- Ponzio HA, Cruz MF. Acura ́cia do exame sob a laˆmpada de Wood na classificac ̧a ̈o dos cloasmas. An Bras Dermatol. 1993:325–8.
- Kang WH, Yoon KH, Lee ES, Kim J, Lee KB, Yim H, et al. Melasma: histopathological characteristics in 56 Korean patients. Br J Dermatol. 2002;146(2): 228–37.
- Grimes PE, Yamada N, Bhawan J. Light microscopic, immunohistochemical, and ultrastructural alter- ations in patients with melasma. Am J Der- matopathol. 2005;27(2):96–101.
- Gautam M, Patil S, Nadkarni N, Sandhu M, Godse K, Setia M. Histopathological comparison of lesional and perilesional skin in melasma: a cross-sectional analysis. Indian J Dermatol Venereol Leprol. 2019;85(4):367–73.
- Cassiano DP, Esposito ACC, Hassun K, Bagatin E, Lima EV, Lima MA, et al. Histological changes in facial melasma after treatment with triple combi- nation cream with or without oral tranexamic acid and/or microneedling, a randomized clinical trial. Indian J Dermatol Venereol Leprol. 2022;11:1–10.
- Grimes P, Bhawan J, Howell M, Desai S, Coryell E, Einziger M, et al. Histopathological changes induced by malassezin: a novel natural microbiome indole for treatment of facial hyperpigmentation. J Drugs Dermatol. 2022;21(2):141–5.
- Torres-Alvarez B, Mesa-Garza IG, Castanedo-Cazares JP, Fuentes-Ahumada C, Oros-Ovalle C, Navarrete- Solis J, et Histochemical and immunohisto- chemical study in melasma: evidence of damage in the basal membrane. Am J Dermatopathol. 2011;33(3):291–5.
- Bacharach-Buhles M, Lubowietzki M, Altmeyer P. Dose-dependent shift of apoptotic and unaltered melanocytes into the dermis after irradiation with UVA Dermatology. 1999;198(1):5–10.
- Esposito ACC, Brianezi G, de Souza NP, Santos DC, Miot LDB, Miot HA. Ultrastructural characterization of damage in the basement membrane of facial melasma. Arch Dermatol Res. 2020;312(3):223–7.
- Bastonini E, Kovacs D, Picardo Skin pigmenta- tion and pigmentary disorders: focus on epider- mal/dermal cross-talk. Ann Dermatol. 2016;28(3): 279–89.
- Hernandez-Barrera R, Torres-Alvarez B, Castanedo- Cazares JP, Oros-Ovalle C, Moncada B. Solar elas- tosis and presence of mast cells as key features in the pathogenesis of melasma. Clin Exp Dermatol. 2008;33(3):305–8.
- Masub N, Nguyen JK, Austin E, Jagdeo J. The vas- cular component of melasma: a systematic review of laboratory, diagnostic, and therapeutic Dermatol Surg. 2020;46(12):1642–50.
- Na JI, Choi SY, Yang SH, Choi HR, Kang HY, Park KC. Effect of tranexamic acid on melasma: a clinical trial with histological evaluation. J Eur Acad Der- matol Venereol. 2013;27(8):1035–9.
- Dias JAF, Lima PB, Cassiano DP, Esposito ACC, Bagatin E, Miot LDB, et Oral ketotifen associated with famotidine for the treatment of facial mel- asma: a randomized, double-blind, placebo- controlled trial. J Eur Acad Dermatol Venereol. 2022;36(2):e123–5.
- Yoshida M, Takahashi Y, Inoue Histamine indu- ces melanogenesis and morphologic changes by protein kinase A activation via H2 receptors in human normal melanocytes. J Invest Dermatol. 2000;114(2):334–42.
- Man XY, Yang XH, Cai SQ, Bu ZY, Wu XJ, Lu ZF, et al. Expression and localization of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 in human epidermal appendages: a comparison study by immunofluo- rescence. Clin Exp Dermatol. 2009;34(3):396–401.
- Abdel-Naser MB, Seltmann H, Zouboulis CC. SZ95 sebocytes induce epidermal melanocyte dendricity and proliferation in vitro. Exp Dermatol. 2012;21(5):393–5.
- Amano S. Possible involvement of basement mem- brane damage in skin photoaging. J Investig Der- matol Symp Proc. 2009;14(1):2–7.
- Bhawan J, Oh CH, Lew R, Nehal KS, Labadie RR, Tsay A, et al. Histopathologic differences in the photoaging process in facial versus arm skin. Am J Dermatopathol. 1992;14(3):224–30.
- Prabha N, Mahajan VK, Mehta KS, Chauhan PS, Gupta
- Cosmetic contact sensitivity in patients with melasma: results of a pilot study. Dermatol Res Pract. 2014;2014:316219.
- Esposito MCC, Esposito ACC, Jorge MFS, D’Elia MPB, Miot HA. Depression, anxiety, and self-esteem in women with facial melasma: an Internet-based survey in Brazil. Int J Dermatol. 2021;60(9):e346–7.
- Franc ̧a MLM, Miot HA, Schmitt JV, Coutinho TV. Evaluation of facial expression recognition in patients with facial melasma: a cross-sectional study. Surg Cosm Dermatol. 2020;12:245–50.
- Adalatkhah H, Sadeghi BH. The association between melasma and postin fl ammatory hyperpigmenta- tion in acne patients. Iran Red Crescent Med J. 2013;15(5):400–
- Adalatkhah H, Sadeghi-bazargani H, Amini-sani N, Zeynizadeh S. Melasma and its association with different types of nevi in women: a case-control study. BMC Dermatol. 2008;8:3.
- Junior VH, Mendes AL, Talhari CC, Miot Impact of environmental changes on Dermatology. An Bras Dermatol. 2021;96(2):210–23.
- Jux B, Kadow S, Luecke S, Rannug A, Krutmann J, Esser C. The aryl hydrocarbon receptor mediates UVB radiation-induced skin tanning. J Invest Der- matol. 2011;131(1):203–10.
- Esser C, Bargen I, Weighardt H, Haarmann-Stem- mann T, Krutmann J. Functions of the aryl hydro- carbon receptor in the skin. Semin Immunopathol. 2013;35(6):677–91.
- Esposito MCC, Esposito Lemos AC, Lemos FK, Jorge MFS, D’Elia MPB, Miot HA. Melasma: Trends in worldwide Internet searches (2000–2019). Indian J Dermatol Venereol Leprol. 2022;88(3):(ahead of print).
- Hushcha Y, Blo I, Oton-Gonzalez L, Mauro GD, Martini F, Tognon M, et microRNAs in the Reg- ulation of Melanogenesis. Int J Mol Sci. 2021;22(11).
- Zhou S, Zeng H, Huang J, Lei L, Tong X, Li S, et al. Epigenetic regulation of melanogenesis. Ageing Res Rev. 2021;69: 101349.
- Kim NH, Choi SH, Kim CH, Lee CH, Lee TR, Lee Reduced MiR-675 in exosome in H19 RNA-related melanogenesis via MITF as a direct target. J Invest Dermatol. 2014;134(4):1075–82.
- Kim NH, Choi SH, Yi N, Lee TR, Lee Arginase-2, a miR-1299 target, enhances pigmentation in mel- asma by reducing melanosome degradation via senescence- induced autophagy inhibition. Pigment Cell Melanoma Res. 2017;30(6):521–30.
- Slominski AT, Zmijewski MA, Plonka PM, Szaflarski JP, Paus How UV light touches the brain and endocrine system through skin, and why. Endocrinology. 2018;159(5):1992–2007.
- Hiramoto K, Yamate Y, Kobayashi H, Ishii M, Sato EF, Inoue M. Ultraviolet B irradiation of the mouse eye induces pigmentation of the skin more strongly than does stress loading, by increasing the levels of prohormone convertase 2 and alpha-melanocyte- stimulating Clin Exp Dermatol. 2013;38(1):71–6.
- Hiramoto K, Sato Ultraviolet B radiation to the eye induces pigmentation in the epidermis via the activation of the subunit gp91 phox of reduced nicotinamide adenine dinucleotide phosphate oxi- dase. Clin Exp Dermatol. 2012;37(1):65–7.

